Кобалт
Кобалт (Co, лат. cobaltum) метал је VIIIB групе са атомским бројем 27.[2] Поседује 17 изотопа чије се атомске масе налазе између 35-64. Постојан је само 59, који чини скоро 100% његовог изотопа у природи. Кобалт је открио Георг Брандт 1735. године.
 | |||||||||||||||||||||||||||||||
| Општа својства | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, симбол | кобалт, Co | ||||||||||||||||||||||||||||||
| Изглед | тврд сјајан плавкасто сив метал | ||||||||||||||||||||||||||||||
| У периодном систему | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Атомски број (Z) | 27 | ||||||||||||||||||||||||||||||
| Група, периода | група 9, периода 4 | ||||||||||||||||||||||||||||||
| Блок | d-блок | ||||||||||||||||||||||||||||||
| Категорија | прелазни метал | ||||||||||||||||||||||||||||||
| Рел. ат. маса (Ar) | 58,933194(4)[1] | ||||||||||||||||||||||||||||||
| Ел. конфигурација | |||||||||||||||||||||||||||||||
по љускама | 2, 8, 15, 2 | ||||||||||||||||||||||||||||||
| Физичка својства | |||||||||||||||||||||||||||||||
| Тачка топљења | 1768 K (1495 °C, 2723 °F) | ||||||||||||||||||||||||||||||
| Тачка кључања | 3200 K (2927 °C, 5301 °F) | ||||||||||||||||||||||||||||||
| Густина при с.т. | 8,90 g/cm3 | ||||||||||||||||||||||||||||||
| течно ст., на т.т. | 8,86 g/cm3 | ||||||||||||||||||||||||||||||
| Топлота фузије | 16,06 kJ/mol | ||||||||||||||||||||||||||||||
| Топлота испаравања | 377 kJ/mol | ||||||||||||||||||||||||||||||
| Мол. топл. капацитет | 24,81 J/(mol·K) | ||||||||||||||||||||||||||||||
Напон паре
| |||||||||||||||||||||||||||||||
| Атомска својства | |||||||||||||||||||||||||||||||
| Електронегативност | 1,88 | ||||||||||||||||||||||||||||||
| Енергије јонизације | 1: 760,4 kJ/mol 2: 1648 kJ/mol 3: 3232 kJ/mol (остале) | ||||||||||||||||||||||||||||||
| Атомски радијус | 125 pm | ||||||||||||||||||||||||||||||
| Ковалентни радијус | ↓: 126±3 ↑: 150±7 pm | ||||||||||||||||||||||||||||||
| Остало | |||||||||||||||||||||||||||||||
| Кристална структура | збијена хексагонална (HCP) | ||||||||||||||||||||||||||||||
| Брзина звука танак штап | 4720 m/s (на 20 °C) | ||||||||||||||||||||||||||||||
| Топл. ширење | 13,0 µm/(m·K) (на 25 °C) | ||||||||||||||||||||||||||||||
| Топл. водљивост | 100 W/(m·K) | ||||||||||||||||||||||||||||||
| Електрична отпорност | 62,4 nΩ·m (на 20 °C) | ||||||||||||||||||||||||||||||
| Магнетни распоред | феромагнетичан | ||||||||||||||||||||||||||||||
| Јангов модул | 209 GPa | ||||||||||||||||||||||||||||||
| Модул смицања | 75 GPa | ||||||||||||||||||||||||||||||
| Модул стишљивости | 180 GPa | ||||||||||||||||||||||||||||||
| Поасонов коефицијент | 0,31 | ||||||||||||||||||||||||||||||
| Мосова тврдоћа | 5,0 | ||||||||||||||||||||||||||||||
| Викерсова тврдоћа | 1043 MPa | ||||||||||||||||||||||||||||||
| Бринелова тврдоћа | 470–3000 MPa | ||||||||||||||||||||||||||||||
| CAS број | 7440-48-4 | ||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||
| Откриће и прва изолација | Георг Брандт (1735) | ||||||||||||||||||||||||||||||
| Главни изотопи | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Po starijem sistemu imenovanja, ubrajao se u 8. sporednu grupu odnosno platinsko-željeznu grupu. Posebnost predstavlja atomska masa prirodnog kobalta, koja iznosi 58,93 te je tako viša od prosječne atomske mase nikla (58,69), elementa koji se nalazi nakon njega u periodnom sistemu. Ovakva posebnost također je prisutna i između argona (39,95) i kalija (39,1) kao i između telura (127,6) i joda (126,9).
Историја
Руде и једињења кобалта су познати већ веома дуго и употребљавали су се претежно за бојење стакла и керамике (кобалтно плаво). У средњем веку, његова једињења су се често сматрали врло вредним рудама сребра и бакра. Међутим, пошто су се врло тешко обрађивали а због удела арсена испуштали су врло неугодне мирисе, доспели су на „зао” глас као „зачарани”. Према легенди, гномови (коболди) су појели вредно сребро а на његово мјесто оставили безвредну руду боје сребра. Поред кобалта, биле су ту и руде волфрама и никла. Ове руде су касније рудари називали погрдним именима попут „никл”, „волфрам” (у слободном преводу „вучија пена” преко латинског lupi spuma), те тако и гномова руда (коболдова руда) из чега је кобалт касније добио и име.[3] Шведски хемичар Георг Брандт је 1735. открио овај, до тада непознат елемент, те му дао данашње име.
Особине
Физичке

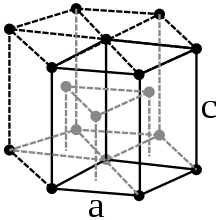
Кобалт је челично-сиви, веома тврди тешки метал, густине од 8,89 g/cm3.[5] Он је феромагнетичан са Киријевом температуром од 1150 °C[5]. Употребљава се као додатак магнетичним рудама.[6] Кобалт се јавља у две модификације: α-кобалт и β-кобалт. Испод 400 °C је стабилна α-модификација, кристализована у хексагонално-најгушћој кристалној структури у просторној групи P63/mmc и параметрима решетке a = 250,7 pm и c = 406,9 pm, као и две формулске јединице по елементарној ћелији. На температури изнад 400 °C прелази у β-облик кобалта са кубном, површински центрираном структуром и параметром решетке a = 354,4 pm.[4]
Као типични метал, кобалт доста добро проводи топлоту и електричну струју (електрична проводљивост износи 26% проводљивости бакра[7]).
Хемијске
У хемијским реакцијама сличан је жељезу и никлу, пошто се стајањем пасивизира (у присуству ваздуха). Раствара се само у киселинама које длују оксидирајуће. Кобалт има електродни потенцијал од −0,277 V те спада у неплемените елементе. У једињењима се јавља претежно у оксидационим стањима +2 и +3. Међутим, у неким једињењима може се јавити и у оксидационим стањима -1, 0, +1, +4 и +5. Кобалт гради велики број углавном обојених комплекса. За разлику од ковалентних једињења, код њега је оксидацијско стање +3 много чешће и стабилније од стања +2.
Изотопи

Познато је укупно 28 изотопа и 10 нуклеарних изомера кобалта између 47Co и 75Co. Природни кобалт се у потпуности (100%) састоји из изотопа 59Co, те је он један од 22 једноизотопских хемијских елемената.[8] Овај изотоп се може испитати помоћу НМР спектроскопије.
Нуклид 57Co распада се захватом електрона на 57Fe. При преласку на основно стање језгра-кћерке емитује гама зрачење, које има енергије од 122,06 keV (85,6%) и 14,4 keV (9,16%).[9] Основни вид примене изотопа 57Co је у Месбауеровој спектроскопији за разлучивање између дво- и тровалентног жељеза.
Најдуговечнији радиоактивни изотоп кобалта је 60Co (кобалт-60 са спином од 5+), који има време полураспада од 5,27 година а распада се прво бета-распадом преко побуђеног стања те затим емисијом гама-зрака (два гама кванта енергија 1,17 и 1,33 MeV[10]) прелази у основно стање нуклида (спин 0+) који се распада на 60Ni (са спином 4+). Из тог разлога 60Co се употребљава као извор гама зрачења за стерилизацију или конзервирање намирница као и за испитивање материјала (зрачењем) и у терапијама рака („кобалтна терапија”).[11] У медицини се такође могу користити и други изотопи попут 57Co или 58Co као трејсери.[5]
Изотоп 60Co се добија искључиво путем активирања 59Co помоћу неутрона. Као извор неутрона за добијање мањих количина служе изотопи који се спонтано распадају као што је 252Cf, dok se za pravljenje većih količina koriste peleti 59Co постављени у ток неутрона у нуклеарним реакторима. Настанак изотопа 60Co из 59Co pод дејством неутронског бомбардовања може се потенцијални злоупотребити и за појачавање деловања атомског оружја, код којег долази до емисије неутрона. Такво атомско оружје где је нуклеарна бојева глава окружена слојем кобалта назива се кобалтна бомба. При детонацији те бомбе настају снажни гама емитери, те околина постаје много јаче контаминирана него што би била озрачена обичном атомском бомбом.[12] Ако се изотоп 60Co не одлаже и складишти према прописима, него се истопи са обичним кобалтом те преради у металне производе и челик, може се десити да тако произведени метални или челични производи буду знатно радиоактивни.[13][14]
У Вуовом експерименту изведеном 1956. кориштен је изотоп 60Co када је помоћу парадокса паритета (парности) откривена сила слабе интеракције.[15]
Заступљеност
Заступљен је у земљиној кори у количини од 20 ppm (енг. parts per million) у облику два минерала: Смалтита и кобалтита које обично прате руде бакра и никла
Једињења
Несиметричне соли кобалта нпр. K3CoO4 имају јаке феромагнетске особине и користе се у електроници. Комплексна једињења карбоникла и фосфини користе се као катализатори многих органских реакција. Раствори соли кобалт (II) i (III) имају крваво-црвену, и плаву боју и користе се у производњи боја.
Биолошки значај
Кобалт је активатор бројних ензима у живим организмима. Витамин B12 (утиче на количину хемоглобина и број црвених крвних зрнаца у крви), садржи у својој структури кобалт који је координативно везан са органским делом молекула и једним CN- јоном. Ипак минималне дневне потребе за кобалтом су веома мале 0,05 ppm.
Референце
Литература
- Harper, E. M.; Kavlak, G.; Graedel, T. E. (2012). „Tracking the metal of the goblins: Cobalt's cycle of use”. Environmental Science & Technology. 46 (2): 1079—86. Bibcode:2012EnST...46.1079H. PMID 22142288. doi:10.1021/es201874e.
- Narendrula, R.; Nkongolo, K. K.; Beckett, P. (2012). „Comparative soil metal analyses in Sudbury (Ontario, Canada) and Lubumbashi (Katanga, DR-Congo)”. Bulletin of Environmental Contamination and Toxicology. 88 (2): 187—92. PMID 22139330. S2CID 34070357. doi:10.1007/s00128-011-0485-7.
- Pauwels, H.; Pettenati, M.; Greffié, C. (2010). „The combined effect of abandoned mines and agriculture on groundwater chemistry”. Journal of Contaminant Hydrology. 115 (1–4): 64—78. Bibcode:2010JCHyd.115...64P. PMID 20466452. doi:10.1016/j.jconhyd.2010.04.003.
- Bulut, G. (2006). „Recovery of copper and cobalt from ancient slag”. Waste Management & Research. 24 (2): 118—24. PMID 16634226. S2CID 24931095. doi:10.1177/0734242X06063350.
- Jefferson, J. A.; Escudero, E.; Hurtado, M. E.; Pando, J.; Tapia, R.; Swenson, E. R.; Prchal, J.; Schreiner, G. F.; Schoene, R. B.; Hurtado, A.; Johnson, R. J. (2002). „Excessive erythrocytosis, chronic mountain sickness, and serum cobalt levels”. Lancet. 359 (9304): 407—8. PMID 11844517. S2CID 12319751. doi:10.1016/s0140-6736(02)07594-3.
- Løvold, T. V.; Haugsbø, L. (1999). „Cobalt mining factory--diagnoses 1822-32”. Tidsskrift for den Norske Laegeforening. 119 (30): 4544—6. PMID 10827501.
- Bird, G. A.; Hesslein, R. H.; Mills, K. H.; Schwartz, W. J.; Turner, M. A. (1998). „Bioaccumulation of radionuclides in fertilized Canadian Shield lake basins”. The Science of the Total Environment. 218 (1): 67—83. Bibcode:1998ScTEn.218...67B. PMID 9718743. doi:10.1016/s0048-9697(98)00179-x.
- Nemery, B. (1990). „Metal toxicity and the respiratory tract”. The European Respiratory Journal. 3 (2): 202—19. PMID 2178966.
- Kazantzis, G. (1981). „Role of cobalt, iron, lead, manganese, mercury, platinum, selenium, and titanium in carcinogenesis”. Environmental Health Perspectives. 40: 143—61. PMC 1568837
 . PMID 7023929. doi:10.1289/ehp.8140143.
. PMID 7023929. doi:10.1289/ehp.8140143. - Kerfoot, E. J.; Fredrick, W. G.; Domeier, E. (1975). „Cobalt metal inhalation studies on miniature swine”. American Industrial Hygiene Association Journal. 36 (1): 17—25. PMID 1111264. doi:10.1080/0002889758507202.
Спољашње везе
- Cobalt at The Periodic Table of Videos (University of Nottingham)
- Centers for Disease and Prevention – Cobalt
- The Cobalt Institute
- Responsible Cobalt Institute Архивирано на сајту Wayback Machine (7. март 2021)


