Vaccí contra la COVID-19
El vaccí contra la COVID-19 o vacuna contra la COVID-19[1] és una vacuna destinada a proporcionar immunitat adquirida contra la COVID-19. Abans de la pandèmia COVID-19, els treballs per desenvolupar una vacuna contra les malalties del coronavirus SARS i MERS van establir un coneixement considerable sobre l'estructura i la funció dels coronavirus, que van accelerar el desenvolupament ràpid durant principis del 2020 de variades plataformes tecnològiques per a una vacuna contra la COVID-19.[2] El 10 de gener de 2020, les dades de la seqüència genètica del virus SARS-CoV-2 es van compartir a través de GISAID i, el 19 de març, la indústria farmacèutica mundial va anunciar un compromís important per abordar la COVID-19.[3]


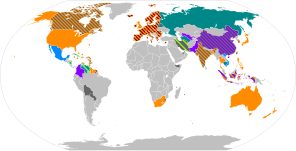
En els assaigs de fase III, diverses vacunes COVID-19 van demostrar eficàcia fins al 95% en la prevenció d'infeccions simptomàtiques COVID-19.[4]
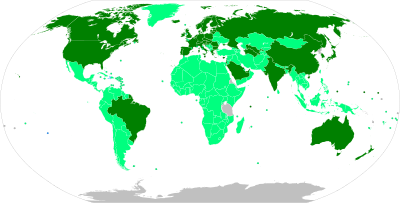
Les autoritats reguladores nacionals han aprovat 40 vacunes per a ús públic:[5]
- una vacuna d'ADN: ZyCoV-D[6]
- quatre vacunes d'ARN (vacuna de Pfizer-BioNTech,[7] vacuna de Moderna[8] Walvax, i Gemcovac
- dotze vacunes inactivades convencionals:[9] BBIBP-CorV, de l'Acadèmia Xinesa de Ciències Mèdiques, CoronaVac, Covaxin, CoviVac, COVIran Barekat, FakhraVac, Minhai, QazVac, WIBP-CorV, Turkovac i VLA2001.
- sis vacunes amb vectors vírics: Sputnik Light, Sputnik V, la vacuna d'Oxford-AstraZeneca, Convidecia, vacuna de Janssen i iNCOVACC.
- setze vacunes peptídiques o de subunitats:Abdala, CNBG, Corbevax, COVAX-19, EpiVacCorona, IndoVac, MVC-COV1901, Noora, Novavax, Razi Cov Pars, Sanofi–GSK, Soberana 02, Soberana Plus, V-01 i ZF2001
- una vacuna de partícules similivíriques: CoVLP
El juliol de 2021 hi havia 330 vacunes estaven en diverses etapes de desenvolupament, amb 102 fase preclínica, 30 en assaigs de fase I-II, 25 en fase III i 8 en fase IV.[5]
Molts països han implementat plans de distribució per fases que donen prioritat a aquells amb major risc de complicacions, com ara la gent gran, i aquells amb un alt risc d'exposició i transmissió, com els treballadors sanitaris.[10] Stanley Plotkin i Neal Halsey van escriure un article publicat al gener de 2021 per Clinical Infectious Diseases que instava a utilitzar una dosi única per estendre la vacunació a tantes persones com sigui possible fins que millorés la disponibilitat de la vacuna.[11] Diversos altres articles i mitjans van proporcionar proves per retardar les segones dosis en la mateixa línia de raonament.[12][13][14]
Al 17 de desembre de 2021, s'han administrat a tot el món 8,63 mil milions de dosis de vacuna COVID-19 segons els informes oficials de les agències nacionals de salut, el que significa que un 56.6% de la població mundial hauria rebut almenys una dosi, però que aquest percentatge baixa a un 7,6% en els països de renda baixa.[15] El desembre de 2020, els països havien encarregat més de 10.000 milions de dosis de vacuna,[16] amb aproximadament la meitat de les dosis adquirides pels països amb ingressos elevats que només representaven el 14% de la població mundial.[17]
Tipus de vacunes
A gener del 2021 hi han nou plataformes tecnològiques diferents, amb la tecnologia de nombroses vacunes candidates sense definir, estaven en recerca i desenvolupament durant el 2020, per crear una vacuna eficaç contra la COVID-19.[5][18] La majoria de les plataformes de vacuna candidates en assaigs clínics a partir de setembre se centren en la proteïna S del coronavirus i les seves variants com a antigen primari de la COVID-19.[18] Les plataformes que es van desenvolupar el 2020 van incloure tecnologies d'àcids nucleics (ADN i ARN missatger amb nucleòsids modificats), vectors vírics que no es reprodueixen, pèptids, proteïnes recombinants, virus vius atenuats i virus inactivats.[2][18][19][20]
Moltes tecnologies de vacunes que s'estan desenvolupant per al COVID-19 no són com les vacunes que ja s'utilitzen per prevenir la grip, sinó que utilitzen estratègies de "nova generació" tenint en compte els mecanismes d'infecció per COVID-19.[2][18][20] Les plataformes vacunals en desenvolupament poden millorar la flexibilitat per a la manipulació de l'antigen i l'eficàcia dels contra els mecanismes concrets de la infecció per COVID-19 en subgrups de població susceptible, com ara treballadors sanitaris, gent gran, nens,[21] dones embarassades i persones amb els seus sistemes immunitaris debilitats.[18][20]
Vacunes d'ARN
Una vacuna d'ARN conté ARN que, quan s'introdueix en un teixit, actua com a ARN missatger (ARNm) per fer que les cèl·lules construeixin la proteïna estranya i estimulin una resposta immunitària adaptativa que ensenya al cos a identificar i destruir el patogen o les cèl·lules canceroses corresponents. Les vacunes d'ARN sovint, però no sempre, utilitzen ARN missatger amb nucleòsids modificats. El lliurament d'ARNm s'aconsegueix mitjançant una coformulació de la molècula en nanopartícules de lípids que protegeixen les cadenes d'ARN i ajuden a la seva absorció a les cèl·lules.[22][23][24][25]
Les vacunes contra l'ARN van ser les primeres vacunes contra la COVID-19 autoritzades als Estats Units i a la Unió Europea.[26][27] A gener de 2021, les vacunes autoritzades d'aquest tipus són la vacuna de Pfizer-BioNTech
Les reaccions al·lèrgiques greus són rares.[30] El desembre de 2020, 1.893.360 primeres dosis d'administració de vacuna Pfizer–BioNTech van donar lloc a 175 casos de reacció al·lèrgica greu, dels quals 21 van ser anafilaxi.[31] Per a 4.041.396 administracions de dosi de vacuna de Moderna el desembre de 2020 i gener de 2021, només es van informar deu casos d'anafilaxi.[31] Les nanopartícules de lípids van ser probablement responsables de les reaccions al·lèrgiques.[31]
Vacunes amb adenovirus com a vectors
Aquestes vacunes són exemples de vacunes de vectors vírics que no es reprodueixen, utilitzant una closca d'adenovirus que conté ADN que codifica una proteïna del SARS-CoV-2.[32][33] Els adenovirus d'aquestes vacunes no es reprodueixen, és a dir, que no formen partícules de virus noves, sinó que produeixen només l'antigen que provoca una resposta immune sistèmica.[32]
El gener de 2021, les vacunes autoritzades d'aquest tipus són la vacuna d'Oxford-AstraZeneca britànica,
La Convidecia i la vacuna de Janssen consten d'una sola injecció, així ofereixen una logística menys complicada; i es poden emmagatzemar sota refrigeració normal durant uns mesos.[34][35]
Sputnik V utilitza Ad26 per a la seva primera dosi, que és la mateixa que l'única dosi de Janssen, i Ad5 per a la segona dosi, que és la mateixa que l'única dosi que Convidecia.[36]
Vacunes de virus inactivats
Les vacunes inactivades[37] consisteixen en partícules de virus que s'han cultivat i que després es maten mitjançant un mètode com la calor o el formaldehid per tal que perdin la capacitat de producció de malalties, però que mantenen l'aptitud d'estimular una resposta immunitària.[38]
A partir de gener de 2021, les vacunes autoritzades d'aquest tipus són la CoronaVac xinesa, BBIBP-CorV
Vacunes de subunitats
Les vacunes de subunitats presenten un o més antígens sense introduir partícules de patògens sencers.[43] Els antígens implicats són sovint subunitats proteiques, però poden ser qualsevol molècula que sigui un fragment del patogen.[44]
A gener de 2021, l'única vacuna autoritzada d'aquest tipus era la vacuna peptídica russa EpiVacCorona.[45] Les vacunes en assaigs clínics inclouen la vacuna de Novavax i RBD-Dimer.[5] La vacuna V451 es trobava prèviament en assaigs clínics, que van interrompre perquè es va trobar que la vacuna pot causar resultats incorrectes per a les proves posteriors del VIH.
Altres tipus
Altres tipus de vacunes que es troben en assaigs clínics inclouen múltiples vacunes d'ADN amb plasmidi,
S’estan desenvolupant i estudiant vacunes orals i intranasals.[28]
Els científics van investigar si les vacunes existents per a afeccions no relacionades podrien reforçar el sistema immunitari i disminuir la gravetat de la infecció per COVID-19.[56] Hi ha proves experimentals que demostren que la vacuna BCG contra la tuberculosi té efectes inespecífics sobre el sistema immunitari, però no hi ha proves que indiquin que aquesta vacuna sigui efectiva contra la COVID-19.[57][58]
Formulació
Diverses vacunes utilitzen adjuvants per millorar la immunogenicitat.[18] Un adjuvant immunològic és una substància formulada amb una vacuna per elevar la resposta immunitària a un antigen, com el virus COVID-19 o el virus de la grip.[59][60] Els adjuvants utilitzats en la formulació de vacunes contra la COVID-19 poden ser particularment eficaços per a tecnologies que utilitzen el virus inactivat i vacunes recombinants basades en proteïnes o basades en vectors.[60] Les sals d'alumini, conegudes com a "alum", van ser el primer adjuvant utilitzat per a les vacunes autoritzades[61] i són l'adjuvant d'elecció en aproximadament el 80% de les vacunes adjuvantades.[60] L'adjuvant d'alum inicia diversos mecanismes moleculars i cel·lulars per millorar la immunogenicitat, inclosa l'alliberament de citocines proinflamatòries.[59][60]
Planificació i desenvolupament
S'avaluen diversos passos al llarg de tota la ruta de desenvolupament, incloent-hi:[19][62]
- nivell de toxicitat acceptable de la vacuna (la seva seguretat),
- dirigit a poblacions vulnerables,
- necessitat d'avenços en l'eficàcia de la vacuna,
- la durada de la protecció de la vacunació,
- sistemes especials de lliurament (com ara oral o nasal, en lloc de la injecció),
- règim d'administració (primera dosi, segona dosi...),
- característiques d'estabilitat i emmagatzematge,
- autorització d'ús d'emergència abans de la llicència formal,
- fabricació òptima per poder subministrar milers de milions de dosis i
- difusió de la vacuna autoritzada.
Al 27 de març de 2021, s'havien administrat a tot el món 541,05 milions de dosis de vacuna contra la COVID-19 segons informes oficials d'agències nacionals de salut recopilades per Our World in Data.[63]
El 17 de febrer de 2021, a L'Estat espanyol s'havien administrat 2,69 milions de dosis de vacunes (5,75/100 habitants).[63]
Història
Després d'aïllar el SARS-CoV-2 el desembre de 2019,[64] la seva seqüència genètica es va publicar l'11 de gener de 2020, provocant una resposta internacional urgent per preparar-se per a un brot i accelerar el desenvolupament d'una vacuna contra la COVID-19.[65][66][67] Des de principis del 2020, el desenvolupament de vacunes es va accelerar mitjançant una col·laboració sense precedents a la indústria farmacèutica multinacional i entre governs.[68] A juny de 2020, corporacions, governs, organitzacions sanitàries internacionals i grups de recerca universitaris van invertir desenes de milers de milions de dòlars per desenvolupar desenes de candidats a la vacuna i preparar-se per a programes globals de vacunació contra la infecció per COVID-19.[66][69][70][71] Segons la Coalició per a les Innovacions en Preparació per Epidèmies (CEPI), la distribució geogràfica del desenvolupament de vacunes COVID-19 fa que les entitats nord-americanes tinguin al voltant del 40% de l'activitat en comparació amb el 30% a Àsia i Austràlia, el 26% a Europa i alguns projectes a Amèrica del Sud i Àfrica.[65][68]
El febrer de 2020, l'Organització Mundial de la Salut (OMS) va dir que no esperava que una vacuna contra el SARS-CoV-2, el virus causant, estigués disponible en menys de 18 mesos.[72] La ràpida taxa d'infecció de COVID-19 a tot el món durant principis del 2020 va estimular les aliances internacionals i els esforços governamentals per organitzar amb urgència recursos per fabricar múltiples vacunes en terminis reduïts,[73] amb quatre candidats vacunats que van entrar a l'avaluació humana el març del 2020.[65][74]
El 24 de juny de 2020, la Xina va aprovar la vacuna de CanSino per a ús limitat a l'exèrcit i dues vacunes contra virus inactivats per a ús d'emergència en ocupacions d'alt risc.[75] L'11 d'agost de 2020, Rússia va anunciar l'aprovació de la seva vacuna Sputnik V per a ús d'emergència, tot i que un mes després només es van distribuir petites quantitats de la vacuna per al seu ús fora de l'assaig de fase III.[76]
El 20 de novembre de 2020, l'associació Pfizer–BioNTech va presentar una sol·licitud EUA a la Food and Drug Administration (FDA) per a la vacuna d'ARNm BNT162b2 (ingredient actiu tozinameran).[77][78] El 2 de desembre de 2020, l'Agència de Regulació de Medicaments i Productes Sanitaris (MHRA) del Regne Unit va aprovar temporalment la regulació de la vacuna de Pfizer-BioNTech,[79][80] convertint-se en el primer país que va aprovar aquesta vacuna i el primer país del món occidental per aprovar l'ús de qualsevol vacuna contra la COVID-19.[81][82][83] A partir del 21 de desembre, molts països i la Unió Europea[84] han autoritzat o aprovat la vacuna de Pfizer-BioNTech contra la COVID-19. Bahrain i els Emirats Àrabs Units van concedir una autorització d'emergència per a la comercialització de BBIBP-CorV, fabricat per Sinopharm.[85][86] L'11 de desembre de 2020, la FDA dels Estats Units va concedir una autorització d'ús d'emergència (EUA) per a la vacuna Pfizer-BioNTech contra la COVID-19.[87] Una setmana més tard, EUA va concedir una autorització per mRNA-1273, la vacuna de Moderna.[88][89][90]
La Gam-COVID-Vac (Sputnik V) russa creà en el seu moment un cert escepticisme tècnic relacionat amb els resultats de les proves inicials,[91][92] una vegada finalitzada la fase III d'un assaig clínic amb 20.000 participants havia demostrat ser segura i altament eficaç com a protecció contra el virus.[93]
El 31 de març de 2021, el govern rus va anunciar que havia registrat la primera vacuna COVID-19 per a animals.[94] Amb el nom de Carnivac-Cov, és una vacuna inactivada per a animals carnívors, incloses les mascotes, dirigida a prevenir les mutacions que es produeixen durant la transmissió interspècie del SARS-CoV-2.[95]
El juny de 2021, un informe va revelar que la vacuna UB-612, desenvolupada per la COVAXX nord-americana, era una empresa iniciada per obtenir beneficis pel fundador de Blackwater, Erik Prince. En una sèrie de missatges de text dirigits a Paul Behrends, l'últim col·laborador reclutat per al projecte COVAXX, Prince va descriure les possibilitats d'obtenir beneficis en vendre les vacunes COVID-19. COVAXX no va proporcionar dades dels assaigs clínics sobre seguretat o eficàcia. La responsabilitat de crear xarxes de distribució es va assignar a una entitat amb seu a Abu Dhabi, que es va esmentar com a "Windward Capital" al capçal de COVAXX, però que en realitat era Windward Holdings. L'únic accionista de la firma, que gestionava "activitats professionals, científiques i tècniques", era Erik Prince. El març de 2021, COVAXX va recaptar 1.350 milions de dòlars en una ubicació privada.[96]Vacunes desenvolupades a Catalunya
Hi ha diverses vacunes en desenvolupament a Catalunya, entre elles una de l'empresa farmacèutica multinacional Laboratoris Hipra d'Amer basada en proteïnes recombinants i una altra en col·laboració amb l'Hospital Clínic de Barcelona basada en ARN missatger.[97][98] També hi ha un assaig de la vacuna RUTI de l'Hospital Germans Trias i Pujol per comprovar si aquesta vacuna contra la tuberculosi és efectiva també contra la Covid, gràcies al fenomen de la immunitat entrenada monocitària.[99]
El 30 de març de 2023 la primera d'elles, amb el nom de Bimervax, va rebre finalment l'aval de l'Agència Europea del Medicament, que ja es va poder administrar com a recordatori a persones de més de 16 anys que haguessin rebut anteriorment una vacuna d'ARNm.
Assajos i autoritzacions de vacunes
Els assaigs de fase I proven principalment la seguretat i la dosificació preliminar en algunes dotzenes de subjectes sans, mentre que els assaigs de fase II, després de l'èxit en la fase I, avaluen la immunogenicitat, els nivells de dosi (eficàcia basats en biomarcadors) i els efectes adversos de la vacuna candidata, normalment en centenars de persones.[100][101] Un assaig de fase I-II consisteix en proves preliminars de seguretat i immunogenicitat, generalment aleatoritzat, controlat amb placebo, alhora que es determinen dosis més precises i efectives.[101] Els assajos de fase III solen implicar més participants en diversos llocs, inclouen un grup de control i proven l'eficàcia de la vacuna per prevenir la malaltia (un assaig "intervencionista" o "pivotal"), mentre es monitoritza els efectes adversos en la dosi òptima.[100][101] La definició de seguretat, eficàcia i criteris clínics de la vacuna en un assaig de fase III pot variar entre els assaigs de diferents empreses, com ara definir el grau d'efectes secundaris, la infecció o la quantitat de transmissió, i si la vacuna prevé una COVID-19 moderada o severa.[102][103][104]
El disseny d'un assaig clínic en curs es pot modificar com a "disseny adaptatiu" si l'acumulació de dades de l'assaig proporciona informació inicial sobre una eficàcia positiva o negativa del tractament.[105][106] Els dissenys adaptatius dels assaigs clínics en fase II-III en curs amb vacunes candidates poden escurçar la durada dels assaigs i utilitzar menys subjectes, possiblement accelerant les decisions per a la finalització primerenca o l'èxit, evitant la duplicació dels esforços de recerca i millorant la coordinació dels canvis de disseny de l'assaig Solidaritat a tot el món.[105][107]
Vacunes aprovades
Les autoritats reguladores nacionals han concedit autoritzacions d'ús d'emergència per a deu vacunes. Tres d'aquestes han estat aprovades per a ús d'emergència o ús complet per les autoritats reguladores estrictes (SRA) reconegudes per l'OMS.
Llistat de vacunes autoritzades
| Nom comú | Tipus (tecnologia) | País d'origen | Primera autorització | Notes |
|---|---|---|---|---|
| Autoritzades a més de 10 països | ||||
| Oxford–AstraZeneca | Vector d'adenovirus | Regne Unit, Suècia | Desembre 2020 | |
| Pfizer–BioNTech | ARN | Alemanya, Estats Units | Desembre 2020 | Tant les versions originals com les variants Òmicron. |
| Janssen (Johnson & Johnson) | Vector d'adenovirus | Estats Units, Països Baixos | Febrer 2021 | |
| Moderna ARN | Estats Units | Desembre 2020 | Tant les versions originals com les variants Òmicron | |
| Sinopharm BIBP | Inactivada | Xina | Juliol 2020 | |
| Sputnik V | Vector d'adenovirus | Rússia | Agost 2020 | |
| CoronaVac | Inactivada | Xina | Agost 2020 | |
| Novavax | Subunitats | Estats Units | Desembre 2021 | Una "vacuna de nanopartícules recombinants"[108] |
| Covaxin | Inactivada | Índia | Gener 2021 | |
| Valneva | Inactivada | França, Àustria | Abril 2022 | |
| Sanofi–GSK | Subunitats | França, Regne Unit | Novembre 2022 | Basat en Variant Beta |
| Sputnik Light | Vector d'adenovirus | Rússia | Maig 2021 | |
| Autoritzades entre 2 i 10 països | ||||
| Convidecia | Vector d'adenovirus | Xina | Juny 2020 | |
| Sinopharm WIBP | Inactivada | Xina | Febrer 2021 | |
| Abdala | Subunitats | Cuba | Juliol 2021 | |
| EpiVacCorona | Subunitats | Rússia | Octubre 2020 | |
| Zifivax | Subunitats | Xina | Març 2021 | |
| Soberana 02 | Subunitats | Cuba, Iran | Juny 2021 | |
| CoviVac | Inactivada | Rússia | Febrer 2021 | |
| Medigen | Subunitats | Taiwan | Juliol 2021 | |
| QazCovid-in | Inactivada | Kazakhstan | Abril 2021 | |
| Minhai | Inactivada | Xina | Maig 2021 | |
| COVIran Barekat | Inactivada | Iran | Juny 2021 | |
| Soberana Plus | Subunitats | Cuba | Agost 2021 | |
| Corbevax | Subunitats | Índia, Estats Units | Desembre 2021 | |
| Autoritzades en 1 país | ||||
| Acadèmia Xinesa de Ciències Mèdiques | Inactivada | Xina | Juny 2021 | |
| ZyCoV-D | ADN | Índia | Agost 2021 | |
| FakhraVac | Inactivada | Iran | Setembre 2021 | |
| COVAX-19 | Subunitats | Austràlia, Iran | Octubre 2021 | |
| Razi Cov Pars | Subunitats | Iran | Octubre 2021 | |
| Turkovac | Inactivada | Turquia | Desembre 2021 | |
| Sinopharm CNBG | Subunitats | Xina | Desembre 2021 | Basat en variants originals, Beta i Kappa |
| CoVLP | Recombinant, Partícula similivírica | Canadà, Regne Unit | Febrer 2022 | |
| Noora | Subunitats | Iran | Març 2022 | |
| Skycovione | Subunitats | Corea del Sud | Juny 2022 | |
| Walvax | ARN | Xina | Setembre 2022 | |
| iNCOVACC | Vector d'adenovirus | Índia | Setembre 2022 | Vacuna nasal |
| V-01 | Subunitats | Xina | Setembre 2022 | |
| Gemcovac | ARN | Índia | Octubre 2022 | Vacuna d'ARN autoamplificant |
| IndoVac | Subunitats | Indonèsia | Octubre 2022 | |
Vacunes candidates
(Actualitzades fins a novembre de 2022)
Amb fase I acabada:
| Vacunes candidates Desenvolupadors, patrocinadors | País d'origen | Tipus (tecnologia) | Fase actual (participants) Disseny | Fase finalitzada[a] (participants) Resposta immunitària | Pendent autorització |
|---|---|---|---|---|---|
| Vacuna de Sanofi-GSK (VAT00002) Sanofi Pasteur, GSK | França, Regne Unit | De subunitats | Fase III (37.430) Un grup paral·lel, multi-etapa, doble cec modificat, multi-armat, per avaluar l'eficàcia, la seguretat i la immunogenicitat de dues vacunes de proteïnes recombinants adjuvantades de SARS-CoV-2 (monovalents i bivalents). -19 en adults majors de 18 anys. Mai 2021 – Gen 2023, Kenya,[113] Mèxic,[114] Estats Units | Fase I–II (1.160) Fase I-IIa (440): Immunogenicitat i seguretat de les formulacions de vacunes (amb o sense adjuvant) en adults sans de 18 anys o més.[115] Fase IIb (720): Immunogenicitat i seguretat de la vacuna amb adjuvant AS03 en adults de 18 anys o més.[116] Set 2020 – Set 2022, Estats Units | Emergència (3+27=31) |
| Nanocovax[121] Nanogen Pharmaceutical Biotechnology JSC | Vietnam | Recombinant de la proteïna S (amb alumini com a adjuvant)[122][123] | Fase III (13.000) Adaptatiu, multicèntric, aleatoritzat, doble cec, controlat amb placebo Jun 2021–Jul 2022, Vietnam | Fase I (620) Fase (60): marca oberta, escalat de la dosi. Fase II (560): aleatorització, doble cec, multicèntric, controlat amb placebo. Des 2020 – Jun 2021, Vietnam | |
| UB-612 United Biomedical,Inc, COVAXX, DASA | Brasil, Estats Units | De subunitats | Fase III (18.320) Fase IIb/III (7.320): aleatoritzat, multicèntric, doble cec, controlat amb placebo, resposta a la dosi. Fase III (11.000) Gen 2021 – Mar 2023, Taiwan (fase 2b/3), Índia (fase 3)[130] | Fase I–II (3.910) Phase 1 (60): Estudi obert Phase IIa (3.850): Estudi controlat amb placebo, aleatoritzat i cec a l'observador. Set 2020 – Gen 2021, Taiwan | |
| SCB-2019 Clover Biopharmaceuticals,[135][136] Dynavax Technologies,[137] CEPI | Xina | De subunitats de la proteïna S amb CpG 1018 combinat i coadjuvant d'alumini | Fase III (30.000) Fase II/III (30.000): Aleatori, doble cec, controlat Fase III (300): Doble cec, aleatoritzat, controlat. Mar 2021 – Oct 2022, Bèlgica, Brasil, Colòmbia, República Dominicana, Alemanya, Nepal, Panamà, Filipines, Polònia, Sud-àfrica, Ucraïna | Fase I–II (950) Fase I (150): aleatoritzada, doble cec, controlada amb placebo, primera en humans. Fase II (800): multicèntric, doble cec, aleatoritzat, controlat.[138] Jun 2020 – Oct 2021, Austràlia (fase 1), Xina (fase 2) | |
| S-268019 Shionogi | Japó | De subunitats | Fase III (54.915) Fase II/III: Etiqueta oberta. Fase III: Aleatoritzat, cec per a l'observador i controlat per placebo. Oct 2021 – Dec Des, Japó (3,100), Vietnam | Fase I–II (300) Aleatori, doble cec, controlat amb placebo, grup paral·lel. Des 2020 – Ago 2021, Japó | |
| Vacuna de l'Hospital de la Xina Occidental Centres de Control i Prevenció de Malalties de la província de Jiangsu, Hospital de la Xina Occidental | Xina | De subunitats (recombinant amb cèl·lules Sf9) | Fase III (40.000) Multicèntric, aleatoritzat, doble cec, controlat amb placebo. Jun 2021 – Feb 2022, Indonèsia, Kenya, Filipines | Fase I–II (5.005) Phase I (45): Monocentre, aleatoritzat, controlat amb placebo, doble cec. Phase IIa (960): Centrocentre, aleatoritzat, doble cec, controlat amb placebo. Phase IIb (4.000): Centrocentre, aleatoritzat, doble cec, controlat amb placebo. Ago 2020 – Mai 2021, Xina | |
| DelNS1-2019-nCoV-RBD-OPT Beijing Wantai Biological Pharmacy, Universitat de Hong Kong | Xina, Hong Kong | Vector víric | Fase III (40.000) Multicèntric, aleatoritzat, doble cec, controlat amb placebo. Oct 2021 – Abr 2022, Filipines | Fase I–II (895) Fase I (60+115=175) Fase II (720) Set 2020 – Set 2022, Xina (60), Hong Kong (115) | |
| Versamune-CoV-2FC Farmacore Biotechnology, PDS Biotechnology Corporation, Facultat de Medicina de Ribeirão Preto | Brasil, Estats Units | De subunitats | Fase III (30.000) Doble cec, controlat aleatoritzat. Ago–Des 2021, Brasil | Fase I–II (360) Doble cec, controlat aleatoritzat. Mar–Ago 2021, Brasil | |
| Vacuna de Walvax Acadèmia de Ciències Militars de l'Exèrcit Popular d'Alliberament, Walvax Biotech[153] | Xina | ARN | Fase III (28.000) Multicèntric, aleatoritzat, doble cec, controlat amb placebo Mai – Oct 2021, Xina[154] | Fase I–II (588) Fase I (168) Fase II (420) Jun 2020 – Mar 2022, Xina[155] | |
| V-01 Livzon Mabpharm, Inc. | Xina | De subunitats | Fase III (22.500) Global, multicèntric, aleatoritzat, doble cec, controlat amb placebo. Ago 2021–Mar 2023, Filipines | Fase I (1.060) Fase I (180): Monocèntric, aleatoritzat, doble cec i controlat amb placebo. Fase II (880): Aleatori, doble cec i controlat amb placebo. Feb–Mai 2021, Xina | |
| ARCT-154 (VBC-COV19-154 a Vietnam)[159][160][161] Arcturus Therapeutics, Vinbiocare | Estats Units, Vietnam | ARN | Fase III (20.600) Fase IIIa (600): aleatoritzada, doble cec, controlada amb placebo. Fase IIIb (20.000): aleatoritzat, doble cec, controlat amb placebo.[162][163] Oct-Des 2021, Vietnam | Fase I–II (400) Fase I (100): aleatoritzada, doble cec, controlada amb placebo. Fase II (300): aleatoritzat, doble cec, controlat amb placebo. Ago-Oct 2021, Vietnam[164] | |
| ReCOV Jiangsu Rec-Biotechnology Co Ltd | Xina | De subunitats (recombinant de dos components: espícula i proteïna RBD (cèl·lula CHO)) | Fase II–III (20.301) Multicèntric, aleatoritzat, doble cec, controlat amb placebo. Des 2021–Des 2022, Xina, Nova Zelanda | Fase I (160) Primer en humans, aleatoritzat, doble cec, controlat amb placebo, de cerca de dosis. Jun–Des 2021, Nova Zelanda | |
| BriLife (IIBR-100) L'Institut d'Investigació Biològica d’Israel | Israel | Estomatitis vesicular com a vector (Recombinant) | Fase III (20.000) Aleatoritzat, multicèntric, controlat amb placebo. Set – Des 2021, Israel | Fase I–II (1.040) Aleatoritzat, multicèntric, controlat amb placebo, escalat de dosis. Oct 2020 – Mai 2021, Israel | |
| Vacuna de Zhongyianke Biotech–Liaoning Maokangyuan Biotech Zhongyianke Biotech, Liaoning Maokangyuan Biotech, Academy of Military Medical Sciences | Xina | De subunitats (Recombinant) | Fase III (14.600) Multicentre internacional, aleatoritzat, doble cec, controlat amb placebo. Set 2021–?, Xina | Fase I–II (696) Fase I (216): Aleatoritzada, controlada amb placebo, doble cec. Fase II (480): Monocentre, aleatoritzada, doble cec, controlada amb placebo.[172] Oct 2020 – Jul 2021, Xina | |
| GX-19 (GX-19N) Genexine consortium,[176][177] International Vaccine Institute | Corea del Sud | Vacuna d'ADN | Fase II–III (14.000) Aleatoritzat, doble cec, controlat amb placebo. Oct 2021 – Oct 2022, Indonèsia, Seül | Fase I–II (410) Fase I-II (170+210+30): Multicèntric, alguns de marca oberta, altres de doble cec, de braç únic, aleatoritzats i controlats amb placebo Jun 2020 – Jul 2021, Seül | |
| GRAd-COV2 ReiThera, Institut Nacional de Malalties Infeccioses "Lazzaro Spallanzani" | Itàlia | Vector d'adenovirus (virus de ximpanzé modificat, GRAd) | Fase III (10.300) Aleatoritzat, estratificat, observador-cec, controlat amb placebo. Mar – Mai 2021, Itàlia | Fase I (90) Els subjectes (dos grups: 18-55 i 65-85 anys) que rebien aleatòriament una de les tres dosis creixents de GRAd-COV2 o un placebo, que després es controlaven durant un període de 24 setmanes. El 93% dels subjectes que van rebre GRAd-COV2 van desenvolupar anticossos. Ago – Des 2020, Roma | |
| Inovio COVID-19 Inovio, CEPI, Institut Nacional de Salut de Corea, Institut Internacional de Vacunes | Corea del Sud, Estats Units | Plàsmid d'ADN lliurat per electroporació | Fase III (7.517) Aleatoritzada, controlada amb placebo, multicèntrica.[184] Nov 2020 – Gen 2023, Brasil, Colòmbia, Mèxic, Filipines, Estats Units | Fase I–II (920) Fase Ia (120): Assaig obert. Fase Ib-IIa (160): assaig de dosis.[185] Fase II (640): aleatoritzat, doble cec, controlat amb placebo, cerca de dosis.[186] Abril 2020 – Feb 2022, Xina (fase II), Corea del Sud (fase Ib-IIa), Estats Units | |
| DS-5670[187] Daiichi Sankyo[188] | Japó | ARN | Fase II–III (5.028) Aleatori, comparador actiu, observador cec. Des 2021 – Jul 2023, Japó | Fase I–II (152) Un estudi de fase 1/2 per avaluar la seguretat, la immunogenicitat i la dosi recomanada de DS-5670a en adults i ancians sans japonesos. Mar 2021 – Jul 2022, Japó | |
| GBP510 SK Bioscience Co. Ltd., GSK | Corea del Sud | De subunitats (Nanopartícula de proteïna recombinant amb coadjuvant amb AS03) | Fase III (4.000) Aleatoritzat, controlat activament, cec-observador, grup paral·lel, multicèntric.[192] Ago-Mar 2022, Corea del Sud | Fase I–II (580) Fase I-II (260-320): controlat amb placebo, aleatoritzat, cec a l’observador i localitzador de dosis. Gen–Ago 2021, Corea del Sud | |
| HGC019 Gennova Biopharmaceuticals, HDT Biotech Corporation[196] | Índia, Estats Units | ARN | Fase II–III (4.400) Un estudi prospectiu, multicèntric, aleatoritzat, controlat activament (amb COVISHIELD), observador cec per avaluar la seguretat, la tolerabilitat i la immunogenicitat en adults sans. Fase II (400) Fase III (4.000) Set 2021 – ?, India | Fase I–II (620) Estudi multi-centre aleatoritzat, de fase I/II, controlat amb placebo, de dosis, grup paral·lel, creuat, per avaluar la seguretat, la tolerabilitat i la immunogenicitat en subjectes adults sans. Estudi obert de fase I (120) en joves sans de 18 a 70 anys. Estudi de fase II (500) observador cec en joves sans de 18 a 75 anys. Abr 2021 – Oct 2021, Índia | |
| KD-414 KM Biologics Co | Japó | Inactivada | Fase II–III (2.000) Multicèntric, obert, no aleatoritzat. Oct 2021 – Mar 2023, Japó | Fase I–II (210) Aleatori, doble cec, control amb placebo, grup paral·lel.[203] Mar 2021 – Des 2022, Japó | |
| LYB001 Patronus Biotech | Xina | Fase II–III (1,900) Fase II: aleatoritzada, doble cec, controlada amb placebo Fase III: amb un sol braç, de marca oberta expandida. Oct 2021 – ?, Laos | Fase I (100) Aleatoritzat, doble cec, controlat amb placebo. Des 2021 – Feb 2022, Laos | ||
| AKS-452 Akston Biosciences, Centre Mèdic Universitari de Groningen | Països Baixos | De subunitats | Fase II–III (1.600) Aleatori, doble cec, controlat amb placebo, grup paral·lel, multicèntric, adaptatiu, pont sense fissures. Oct 2021–Des 2022, Índia | Fase I–II (112) No aleatoritzat, únic centre, d'etiqueta oberta, combinatòria. Abr–Set 2021, Països Baixos | |
| AG0302-COVID‑19 AnGes Inc.,[209] AMED | Japó | Plàsmid d'ADN | Fase II–III (500) Aleatoritzat, doble cec, controlat amb placebo[210] Lloc(s): Japó Durada: Nov 2020 – Mai 2021 | Fase I–II (30) No aleatoritzat, monocentre, dues dosis Lloc(s): Osaka Durada: Jun 2020 – Nov 2020 | |
| 202-CoV Shanghai Zerun Biotechnology Co., Ltd., Walvax Biotech | Xina | Recombinant de la proteïna S (amb alumini com a adjuvant) | Fase II (1.056) Aleatoritzat, doble cec, controlat amb placebo. Jul–Des 2021, Xina | Fase I (144) Aleatoritzat, doble cec, controlat amb placebo. Jul–Des 2021, Xina | |
| Vacuna de Vaxart contra la COVID-19 Vaxart | Estats Units | Vector víric | Fase II (896) Doble cec, multicèntric, aleatoritzat, controlat amb placebo, de dosi. Oct 2021 – Mar 2022, Estats Units | Fase I (83) Fase Ia (35): doble cec, aleatoritzat, controlat amb placebo, primer en humans. Fase Ib (48): multicèntric, aleatoritzat, doble cec, controlat amb placebo. Sep 2020 – Ago 2021, Estats Units | |
| PTX-COVID19-B[216] Providence Therapeutics | Canadà | ARN | Fase II (890) Aleatori, dos braços, observador cec. Ago 2021–Feb 2022, Canadà | Fase I (60) Primer en humà, cec per l'observador, aleatoritzat, controlat amb placebo.[218] Gen–Mai 2021, Canadà | |
| Sense nom Ningbo Rong’an Biological Pharmaceutical Co., Ltd. | Xina | Inactivada | Fase II (600) Aleatoritzat, doble cec, controlat amb placebo. Oct 2021 – Mar 2022, Xina | Fase I (150) Aleatoritzat, doble cec, controlat amb placebo. Ago – Oct 2021, Xina | |
| Sense nom Tsinghua University, Tianjin Medical University,[221] Walvax Biotech | Xina | Vector víric | Fase II (360) Jul–Nov 2021, Xina | Fase I (60) Mai–Jun 2021, Xina | |
| INNA-051 Ena Respiratory | Austràlia | Vector víric | Fase II (423) Aleatori, doble cec, controlat amb placebo. Mar – Des 2022, Austràlia | Fase I (124) Aleatori, doble cec, controlat amb placebo. Jun – Oct 2021, Austràlia | |
| mRNA-1283 Moderna | Estats Units | ARN | Fase II (420) Aleatoritzat, estratificat, cec a l'observador. Des 2021 – Gen 2023, Estats Units | Fase I (106) Estudi aleatoritzat, cec per a l'observador i amb dosis. Mar 2021 – Abr 2022, Estats Units | |
| Sense nom Ihsan Gursel, Consell d'Investigacions Científiques i Tecnològiques de Turquia | Turquia | Partícula similivírica | Fase II (330) Assignació aleatòria, dosi paral·lela, doble cec, multi-centre. Jun – Set 2021, Turquia | Fase I (36) doble cec, aleatoritzat, controlat amb placebo. Mar 2021 – Mar 2022, Turquia | |
| COH04S1 City of Hope Medical Center | Estats Units | Vector víric | Fase II (240) Multicèntric, cec a l'observador, controlat per la vacuna a EUA, aleatoritzat. Ago 2021 – Jun 2023, Califòrnia | Fase I (129) Estudi d’escalada de la dosi. Des 2020 – Nov 2022, Califòrnia | |
| ABNCoV2 Bavarian Nordic.[232] Radboud University Nijmegen | Dinamarca, Països Baixos | Partícula similivírica | Fase II (210) Assaig de dosi en un únic centre, seqüencial, amb etiqueta oberta. Ago-Des 2021, Alemanya | Fase I (42) Assaig de dosi en un únic centre, seqüencial, amb etiqueta oberta. Mar–Des 2021, Països Baixos | |
| A més de la catalana d'Hipra, podeu trobar la resta dels estudis en fase preclínica aquí en anglès | |||||
| PHH-1V Hipra[236] | Espanya | De subunitats | Fase I–II (286) Fase I/IIa (30): aleatoritzat, controlat, cec per l'observador, escalada de dosi. Fase IIb (256): aleatoritzat, controlat, cec a l'observador. Ago–Des 2021, Espanya (fase I/IIa), Vietnam (fase IIb) | Preclínic | |
| Vacuna de CureVac (CVnCoV) CureVac, CEPI | Alemanya | ARNm amb ARNmod[239] | Finalitzat (44.433) Fase2b/3 (39.693): Assaig multicèntric d'eficàcia i seguretat en adults. Fase3 (2.360+180+1.200+1.000=4.740): Aleatoritzat, cegat per l'observador, controlat amb placebo. Nov 2020 – Sep 2021, Argentina, Bèlgica, Colòmbia, República Dominicana, França, Alemanya, Mèxic, Països Baixos, Panamà, Perú, Espanya[244] | Fase I–II (944) Phase 1 (284): Parcialment cec, controlat, amb dosi escalada per avaluar la seguretat, la reactogenicitat i la immunogenicitat. Fase 2a (660): Observador parcialment cec, multicèntric, controlat, amb confirmació de dosi. | Emergència (1+27)=28 |
Vacunació heteròlega de sensibilització-reforç
Alguns experts creuen que les pautes de vacunació heteròlega (vacunes diferents) per a la vacuna inicial de sensibilització i per la segona vacuna de reforç) poden augmentar la immunitat, i diversos estudis han començat a examinar aquest efecte.[248] Malgrat l'absència de dades clíniques sobre l'eficàcia i seguretat d'aquestes combinacions heteròlegues, el Canadà i diversos països europeus han recomanat una segona dosi heteròloga per a les persones que han rebut la primera dosi de la vacuna Oxford-AstraZeneca.[249]
| Primera dosi | Segona dosi | Dies entre dosis | Fase actual (participants), períodes i ubicacions |
|---|---|---|---|
| Oxford–AstraZeneca Pfizer–BioNTech | Oxford–AstraZeneca Pfizer–BioNTech | 28 84 | Fase II (820) Feb – Ago 2021, Regne Unit |
| Sputnik Light | Oxford–AstraZeneca Moderna BBIBP-CorV | Fase II (121) Feb – Ago 2021, Argentina | |
| Oxford–AstraZeneca Pfizer–BioNTech | Oxford–AstraZeneca Pfizer–BioNTech Moderna Novavax | 56 – 84 | Fase II (1.050) Mar 2021 – Set 2022, Regne Unit |
| Convidecia | ZF2001 | 28 56 | Fase IV (120) Abr – Des 2021, Xina |
| Oxford–AstraZeneca | Pfizer–BioNTech | 28 | Fase II (676) Abr 2021 – Abr 2022, Espanya |
| Oxford–AstraZeneca Pfizer–BioNTech Moderna | Pfizer–BioNTech Moderna | 28 112 | Fase II (1.200) Mai 2021 – Mar 2023, Canadà |
| Pfizer–BioNTech Moderna | Pfizer–BioNTech Moderna | 42 | Fase II (400) Mai 2021 – Gen 2022, França |
| Oxford–AstraZeneca | Pfizer–BioNTech | 28 21 – 49 | Fase II (3.000) Mai – Des 2021, Àustria |
| Janssen | Pfizer–BioNTech Janssen Moderna | 84 | Fase II (432) Jun 2021 – Set 2022, Països Baixos |
Eficàcia
L'eficàcia d'una nova vacuna es defineix per la seva eficàcia durant els assaigs clínics. L'eficàcia és el risc de contraure la malaltia per part dels participants vacunats de l'assaig en comparació amb el risc de contraure la malaltia per part dels participants no vacunats. Una eficàcia del 0% significa que la vacuna no funciona (idèntica al placebo). Una eficàcia del 50% significa que hi ha la meitat de casos d'infecció que en individus no vacunats.
No és senzill comparar l'eficàcia de les diferents vacunes perquè els assaigs es van realitzar amb diferents poblacions, geografies i variants del virus.[259][260] En el cas de COVID-19, una eficàcia de la vacuna del 67% pot ser suficient per frenar la pandèmia, però això suposa que la vacuna confereix immunitat esterilitzant, que és necessària per evitar la transmissió. L'eficàcia de les vacunes reflecteix la prevenció de la malaltia, un indicador deficient de transmissibilitat del SARS-CoV-2, ja que les persones asimptomàtiques poden ser altament infeccioses.[261] L'Administració d'Aliments i Fàrmacs (FDA) i l'Agència Europea de Medicaments (EMA) van establir un límit del 50% com a eficàcia necessària per aprovar una vacuna contra la COVID-19.[262][263] Amb l'objectiu d'una taxa de cobertura de vacunació de la població realista del 75% i, en funció del nombre reproductiu bàsic actual, s'espera que l'eficàcia necessària d'una vacuna contra la COVID-19 sigui d'un 70% com a mínim per prevenir una epidèmia i d'un 80% com a mínim per extingir-la. sense més mesures, com ara el distanciament social.[264]
En els càlculs d'eficàcia, la COVID-19 simptomàtica es defineix generalment com amb una prova de la PCR positiva i com a mínim un o dos d'una llista definida de símptomes de la COVID-19, tot i que les especificacions exactes varien entre assaigs. La ubicació de l'assaig també afecta l'eficàcia reportada perquè diferents països tenen prevalences diferents de variants del SARS-CoV-2. Els rangs següents són intervals de confiança del 95% tret que s'indiqui el contrari, i tots els valors són per a tots els participants independentment de l'edat. L'eficàcia contra la COVID-19 greu és la més important, ja que les hospitalitzacions i les defuncions són una càrrega de salut pública la prevenció de les quals és prioritària.[265] Les vacunes autoritzades i aprovades han mostrat les següents eficàcies:
| Vacuna | Eficàcia per gravetat de la COVID-19 | Localització de prova | Referències | ||
|---|---|---|---|---|---|
| Lleu o moderada[A] | Greu sense hospitalització ni mort[B] | Greu amb hospitalització o mort[C] | |||
| Oxford-AstraZeneca | 81% (60–91%)[D] | 100% (97.5% IC, 72–100%) | 100%[E] | Multinacional | [266] |
| 74% (68–82%)[F] | 100%[E] | 100%[E] | Estats Units | [267] | |
| Pfizer-BioNTech | 95% (90–98%)[G] | 66% (−125–96%)[H][G] | Multinacional | [269] | |
| 95% (90–98%)[G] | No notificat | No notificat | Estats Units | [268] | |
| Janssen | 66% (55–75%)[I][J] | 85% (54–97%)[J] | 100%[E][J][K] | Multinacional | [270] |
| 72% (58–82%)[I][J] | 86% (−9–100%)[J] | 100%[E][J][K] | Estats Units | ||
| 68% (49–81%)[I][J] | 88% (8–100%)[J] | 100%[E][J][K] | Brasil | ||
| 64% (41–79%)[I][J] | 82% (46–95%)[J] | 100%[E][J][K] | Sud-àfrica | ||
| Moderna | 94% (89–97%)[L] | 100%[E][M] | 100%[E][M] | Estats Units | [272] |
| BBIBP-CorV | 78% (65–86%) | 100%[E] | 100%[E] | Multinational | [273] |
| 79% (66–88%) | No notificat | 79% (26–94%)[H] | Multinational | [274] | |
| Sputnik V | 92% (86–95%) | 100% (94–100%) | 100%[E] | Rússia | [275] |
| CoronaVac | 51% (36–62%)[N] | 84% (58–94%)[N] | 100% (56–100%)[N] | Brasil | [276][277][278] |
| 84% (65–92%) | 100%[E] | 100% (20–100%)[H] | Turquia | [278] | |
| Covaxin | 78% (61–88%)[N] | 93% (57–100%)[N] | Índia | [279][font poc fiable?] | |
| Sputnik Light | 79%[E] | No notificat | No notificat | Rússia | [280] |
| Convidecia | 66%[E][N] | 91%[E][N] | No notificat | Multinacional | [281][font poc fiable?] |
| WIBP-CorV | 73% (58–82%) | 100%[E][O] | 100%[E][O] | Multinational | [273] |
| Abdala | 92% (86–96%) | No notificat | No notificat | Cuba | [282][283][font poc fiable?] |
| Soberana 02 | 62%[E] | 63%[E] | No notificat | Cuba | [284][font poc fiable?] |
| Soberana 02 i Soberana Plus | 92% (87–96%) | 100%[E] | No notificat | Cuba | |
| Novavax | 90% (75–95%) | 100%[E][O] | 100%[E][O] | United Kingdom | [285][286][287] |
| 60% (20–80%)[H] | 100%[E][O] | 100%[E][O] | Sud-àfrica | ||
| 90%[E] | No notificat | No notificat | Estats Units | ||
| No notificat | No notificat | Mèxic | |||
| CureVac | 48%[E] | No notificat | No notificat | Multinational | [288] |
| ZyCoV-D | 67%[E] | No notificat | No notificat | Índia | [289][font poc fiable?] |
| ZF2001 | 82%[E] | No notificat | No notificat | Multinational | [290][font poc fiable?] |
| SCB-2019 | 79%[E] | No notificat | No notificat | Multinational | [291] |
Variants
L'aparició potencial d'una variant SARS-CoV-2 que sigui moderadament o totalment resistent a la resposta d'anticossos provocada per l'actual generació de vacunes COVID-19 pot requerir la modificació de les vacunes.[292] Els assaigs indiquen que moltes vacunes desenvolupades per a la soca inicial tenen una eficàcia menor per a algunes variants contra la COVID-19 simptomàtica.[293] A febrer de 2021, l'FDA creia que totes les vacunes que ella va autoritzar continuaven sent efectives per protegir contra les soques circulants de SARS-CoV-2.[292]
Alfa (llinatge B.1.1.7)
L'evidència limitada de diversos estudis preliminars revisats per l'OMS ha indicat que s'ha mantingut l'eficàcia/efectivitat contra la malaltia per l'Alfa amb les vacunes d'Oxford-AstraZeneca, Pfizer-BioNTech i Novavax, sense dades per a altres vacunes encara. És rellevant la forma en què les vacunes poden acabar amb la pandèmia evitant la infecció asimptomàtica, també indicant la conservació de la neutralització dels anticossos contra l'Alfa amb la majoria de les vacunes àmpliament distribuïdes (Sputnik V, Pfizer-BioNTech, Moderna, CoronaVac, BBIBP-CorV, Covaxin), amb una reducció mínima a moderada amb l'Oxford–AstraZeneca i encara no hi ha dades per a altres vacunes.[294]
Al desembre de 2020, es va identificar al Regne Unit una nova variant SARS-CoV-2, la variant Alfa o llinatge B.1.1.7.[295]
Els primers resultats suggereixen protecció a la variant de les vacunes Pfizer-BioNTech i Moderna.[296][297]
Un estudi va indicar que la vacuna d'Oxford-AstraZeneca tenia una eficàcia del 42-89% contra l'Alfa, enfront del 71-91% contra les altres variants.[298]
Les dades preliminars d'un assaig clínic indiquen que la vacuna Novavax és ~96% efectiva per als símptomes contra la variant original i ~86% contra l'Alfa.[299]
Beta (llinatge B.1.351)
L'evidència limitada de diversos estudis preliminars revisats per l'OMS ha indicat una reducció de l'eficàcia/efectivitat contra les malalties per Beta amb les vacunes d'Oxford–AstraZeneca (possiblement substancial), Novavax (moderada), Pfizer-BioNTech i Janssen (mínima), sense dades per a altres vacunes encara. És rellevant la forma en què les vacunes poden acabar amb la pandèmia evitant la infecció asimptomàtica, també han indicat una neutralització dels anticossos possiblement reduïda contra la Beta amb la majoria de les vacunes àmpliament distribuïdes (Oxford–AstraZeneca, Sputnik V, Janssen, Pfizer–BioNTech, Moderna, Novavax; reducció mínima a substancial), excepte CoronaVac i BBIBP-CorV (reducció mínima a modesta), sense dades per a altres vacunes encara.[294]
Moderna ha llançat un assaig d'una vacuna per combatre la variant o llinatge Beta B.1.351.[300] Al març de 2021, Pfizer va anunciar que l'activitat de neutralització es va reduir en dos terços per a aquesta variant, tot afirmant que encara no es podien fer afirmacions definitives sobre l'eficàcia de la vacuna a l'hora de prevenir-la.[301] Diversos estudis van confirmar posteriorment la disminució de l'activitat neutralitzadora dels sèrums de pacients vacunats amb les vacunes Moderna i Pfizer-BioNTech contra la Beta.[297][302] L'1 d'abril de 2021, una actualització d'un assaig sud-africà de la de Pfizer/BioNTech va afirmar que la vacuna era 100% efectiva fins al moment (és a dir, els participants vacunats no van veure cap cas), essent la variant Beta present en sis de les nou infeccions del grup control placebo.[303]
Al gener de 2021, Johnson & Johnson o Janssen, que va realitzar assaigs per a la seva vacuna Ad26.COV2.S a Sud-àfrica, va informar que el nivell de protecció contra la infecció de moderada a severa era del 72% als Estats Units i del 57% a Sud-àfrica.[304]
El 6 de febrer de 2021, el Financial Times va informar que les dades dels assaigs provisionals d'un estudi de la Universitat sud-africana de Witwatersrand juntament amb la Universitat d'Oxford van demostrar una reducció de l'eficàcia de la vacuna Oxford-AstraZeneca contra la variant.[305] L'estudi va trobar que amb una mostra de 2.000 persones, la vacuna AZD1222 només proporcionava una "mínima protecció" en tots els casos excepte en els més greus de COVID-19.[306] El 7 de febrer de 2021, el ministre de Salut de Sud-àfrica va suspendre el desplegament previst d'un milió de dosis de la vacuna mentre examinaven les dades i esperaven consells sobre com procedir.[306][307]
Al març de 2021, es va informar que la "eficàcia preliminar" de la vacuna Novavax (NVX-CoV2373) contra la Beta per a la COVID-19 lleu, moderada o severa, per als participants amb VIH negatiu era del 51%.[308]
Gamma (llinatge P.1)
L'evidència limitada de diversos estudis preliminars revisats per l'OMS ha indicat una eficàcia/eficiència probablement conservada contra la Gamma amb les vacunes de CoronaVac i BBIBP-CorV, sense dades per a altres vacunes encara. És rellevant la forma en què les vacunes poden acabar amb la pandèmia evitant la infecció asimptomàtica, també han indicat la conservació de la neutralització d'anticossos contra la Gamma amb les d'Oxford–AstraZeneca i CoronaVac (reducció mínima) i una neutralització lleugerament reduïda amb les de Pfizer–BioNTech i Moderna (reducció mínima a moderada), encara sense dades sobre altres vacunes.[294]
La variant Gamma o variant del llinatge P.1 (també coneguda com a 20J/501Y.V3), identificada inicialment al Brasil, sembla escapar parcialment de la vacunació amb la vacuna de Pfizer-BioNTech.[302]
Delta (llinatge B.1.617)
L'evidència limitada de diversos estudis preliminars revisats per l'OMS ha indicat que és probable que es mantingui l'eficàcia/eficiència contra la Delta amb les vacunes d'Oxford-AstraZeneca i Pfizer-BioNTech, sense dades per a altres vacunes encara. És rellevant la forma en què les vacunes poden acabar amb la pandèmia evitant la infecció asimptomàtica, també han indicat una reducció de la neutralització dels anticossos contra la Delta amb les d'Oxford–AstraZeneca (reducció substancial), Pfizer-BioNTech i Covaxin (reducció de moderada a moderada), sense dades per a altres vacunes encara.[294]
L'octubre de 2020 es va descobrir a l'Índia una nova variant que va rebre el nom de llinatge B.1.617. Hi va haver molt poques deteccions fins al gener del 2021, però a l'abril s'havia estès a almenys 20 països de tots els continents, excepte l'Antàrtida i Amèrica del Sud.[309][310][311] Entre unes 15 mutacions definidores, té mutacions de punta D111D (sinònim), G142D, [es necessita una cita mèdica] P681R, E484Q[312] i L452R,[313] aquestes dues últimes poden fer que eviti fàcilment els anticossos.[314] La variant s'ha referit sovint com a "doble mutant", tot i que en aquest sentit no és inusual.[313] En una actualització del 15 d'abril de 2021, PHE va designar el llinatge B.1.617 com a "Variant sota investigació", VUI-21APR-01.[315] El 6 de maig de 2021, Public Health England va escalar el llinatge B.1.617.2 d'una variant sota investigació a una variant preocupant basant-se en una avaluació de la transmissibilitat que era almenys equivalent a la variant Alfa.[316]
Limitacions potencials
El ràpid desenvolupament i la urgència de produir una vacuna per a la pandèmia COVID-19 poden augmentar els riscos i la taxa de fracàs de lliurar una vacuna segura i eficaç.[2][20][317] Un estudi va trobar que entre el 2006 i el 2015, la taxa d'èxit d'obtenir l'aprovació des de la fase I a la fase III en els assaigs va ser del 16,2% per a les vacunes,[318] i el CEPI indica una taxa d'èxit potencial del 10% només per als candidats a vacunes en el desenvolupament del 2020.[20][319][320]
Preocupació per a la bioseguretat
Les primeres investigacions per avaluar l'eficàcia de la vacuna mitjançant models animals específics per a COVID-19, com ara ratolins transgènics ECA2, altres animals de laboratori i primats no humans, indiquen la necessitat de mesures de contenció de nivell de bioseguretat 3 per al maneig de virus vius i coordinació internacional per garantir procediments de seguretat estandarditzats.[2][20]
Potenciació per anticossos de la infecció
Tot i que la qualitat i quantitat de producció d'anticossos per part d'una vacuna potencial està destinada a neutralitzar la infecció per COVID-19,[321] una vacuna podria tenir un efecte contrari no desitjat en provocar un augment de la malaltia dependent d'anticossos (ADE), que augmenta la fixació del virus a les seves cèl·lules diana, i llavors provocar una tempesta de citocines si més tard una persona vacunada és atacada pel virus.[2][322] La plataforma tecnològica de les vacunes (per exemple, la vacuna de vector víric, la vacuna contra la proteïna S o una subunitat proteica), la dosi de la vacuna, el moment de repetir la vacuna per una possible recurrència de la infecció per COVID-19 i l'edat avançada són factors que determinen el risc i extensió d'una possible ADE.[2][322] La resposta dels anticossos a una vacuna és una variable de les tecnologies vacunals en desenvolupament, incloent si la vacuna té precisió en el seu mecanisme,[2] i l'elecció de la ruta d'administració (intramuscular, intradèrmica, oral o nasal).[322][323]
Eficàcia
Les mutacions del virus poden alterar la seva estructura dirigida per la vacuna, fent que la vacuna sigui ineficaç.[324][325][326] Com a exemple d'aquest últim, és poc probable que la versió mutada del virus del brot de Cluster 5, que afecta els visons a Dinamarca, respongui a les vacunes que s'estan desenvolupant actualment, segons alguns investigadors.[327] Un estudi canadenc, ara per ara pendent de revisió per experts, posa de manifest que una dosi de Vaxzevria té una efectivitat del 82% i del 87% contra l'hospitalització o la mort com a conseqüència de la infecció per les variants Beta/Gamma i Delta del virus, respectivament.[328]
Inscripció de participants en proves
Els desenvolupadors de vacunes han d'invertir recursos a nivell internacional per trobar prou participants per a assajos clínics de fase II-III quan el virus ha demostrat ser un "objectiu en moviment" de canviar la velocitat de transmissió entre països i dins d'ells, obligant les empreses a competir pels obtenir participants en la prova.[102] Com a exemple al juny, el desenvolupador xinès de vacunes Sinovac va formar aliances amb Malàisia, Canadà, el Regne Unit i Brasil per tal de reclutar participants.[102] A mesura que la pandèmia COVID-19 a la Xina es va anar fent més aïllada i controlada, els desenvolupadors de vacunes xineses van buscar relacions internacionals per dur a terme estudis humans avançats a diversos països, creant competència per als participants de la prova amb altres fabricants i l'assaig internacional Solidaritat organitzat per l'OMS.[102] A més de la competència sobre la contractació de participants, els organitzadors d'assaigs clínics poden trobar-se amb persones que no vulguin vacunar-se a causa d'estar-hi en contra[329] o al no creure en la ciència de la tecnologia de la vacuna i en la seva capacitat per prevenir la infecció.[330]
Tenir un nombre insuficient de membres de l'equip qualificat per administrar les vacunes pot dificultar els assajos clínics que han de superar els riscos de fracàs de l'assaig, com ara el reclutament de participants en regions geogràfiques rurals o de baixa densitat, i les variacions d'edat, raça, ètnia o afeccions mèdiques subjacents.[102][331]
Refús a les vacunes
Al voltant del 10% del públic percep les vacunes com a insegures o innecessàries, rebutjant la vacunació,[332][333] fet que augmenta el risc de propagació viral addicional que podria provocar brots de COVID-19.[329] A mitjan 2020, les estimacions de dues enquestes indicaven que el 67% o el 80% de les persones als Estats Units acceptaria una nova vacuna contra la COVID-19, amb una gran disparitat per nivell d'educació, estat laboral, raça i geografia.[334][335]
Una enquesta duta a terme per National Geographic i Morning Consult va demostrar una bretxa de gènere en la intenció de prendre una vacuna COVID-19 als EUA, amb un 69% dels homes enquestats que prendrien la vacuna, en comparació amb només el 51% de les dones. L'enquesta també va mostrar una correlació positiva entre el nivell educatiu i la voluntat de prendre la vacuna.[336]
Segons un estudi multicèntric fet als EUA, 182 milions d'habitants del país estaven completament vacunats contra la COVID-19, amb dosis de Pfizer-BioNTech (BNT162b2), Moderna (mRNA-1273) i Janssen (Johnson & Johnson; Ad.26.COV2.S) a finals de setembre de 2021. Encara que els receptors de les vacunes tingueren taxes de mortalitat no relacionades amb la malaltia menors que les de les persones no vacunades, després d'ajustar les dades per edat, sexe, raça i etnicitat i lloc del estudi es va observar que el nombre de vacunacions diàries havia disminuït un 78% des de mitjans d'abril del mateix any, un fet que els investigadors atribuïren a un augment generalitzat de les dubtes sobre la seva eficàcia.[337]
Cost
Una vacuna eficaç contra la COVID-19 podria estalviar bilions de dòlars en impacte econòmic mundial i, per tant, faria que qualsevol preu dels milers de milions resultés petit en comparació.[338] En les primeres etapes de la pandèmia, no se sabia si seria possible crear una vacuna segura, fiable i assequible per a aquest virus, i no se sabia exactament quant podia costar el desenvolupament de la vacuna.[19][319][339] Hi havia la possibilitat que es poguessin invertir milers de milions de dòlars sense èxit.[340]
Un cop es desenvolupés una vacuna eficaç, caldria fabricar i distribuir milers de milions de dosis a tot el món. A l'abril de 2020, la Fundació Gates va estimar que la fabricació i la distribució podrien costar fins a 25.000 milions de dòlars EUA.[341] El 4 de maig de 2020, la Comissió Europea va organitzar i va celebrar una videoconferència de líders mundials en què es van recaptar 8.000 milions de dòlars EUA per al desenvolupament de la vacuna COVID-19.[342]
Al novembre de 2020, les empreses subvencionades en el marc del programa Operation Warp Speed dels Estats Units han fixat un preu inicial entre 19,50 i 25 dòlars EUA per dosi, en línia amb la vacuna antigripal.[343]
El desembre de 2020, una política belga va publicar breument els preus confidencials acordats entre els productors de vacunes i la Unió Europea:[344]
| Fabricant | Preu per dosi a la UE[345] |
|---|---|
| AstraZeneca | 1,78 € |
| Janssen | 8,50$ |
| Sanofi/GSK | 7,56 € |
| Pfizer/BioNTech | 12,00 € |
| Curevac | 10,00 € |
| Moderna | 18,00$ |
Distribució
Les diferents vacunes tenen requisits d'enviament i manipulació diferents. Per exemple, la vacuna de Pfizer/BioNTech tozinameran s'ha d'enviar i emmagatzemar entre −80 i −60 °C,[346] s'ha d'utilitzar en un termini de cinc dies de descongelació,[346] i té un ordre mínim de 975 dosis, pel que és poc probable que es distribueixi en entorns diferents al que són els entorns de grans hospitals ben equipats.[347] Els vials de vacunes de Moderna requereixen emmagatzematge a més de -40 °C i una refrigeració entre -25 i -15 °C en la distribució. Un cop refrigerada, la vacuna Moderna COVID-19 es pot mantenir entre 2 i 8 °C durant un màxim de 30 dies.[348]
Manca de dades públiques i confiança
Per exemple, l'aprovació dels Emirats Àrabs Units de la vacuna xinesa BBIBP-CorV es feu amb manca notable de dades i altres detalls crítics.[349] A diferència de les vacunes que es desenvolupen en alguns països occidentals, hi ha poca informació pública sobre la seguretat o l'eficàcia de les vacunes xineses.[350] Tot i que els Emirats Àrabs Units van dir que havien revisat les dades de Sinopharm en una anàlisi provisional, no hi havia cap indicació que s'hagués analitzat de manera independent les dades en brut. No està clar com Sinopharm va treure conclusions de les dades, ja que els Emirats Àrabs Units no van indicar detalls crítics de l'anàlisi, com ara el nombre de casos de COVID-19 o l'edat dels voluntaris.[349] Zhengming Chen, epidemiòleg de la Universitat d'Oxford, va dir: "És difícil saber fins a quin punt funciona la vacuna. Espero que sigui real".[351]
Desinformació
A principis de 2020, les publicacions a les xarxes socials promogueren una teoria conspiratòria segons la qual una vacuna contra la COVID-19 ja estava disponible. Les patents citades per diverses publicacions en aquests mitjans de comunicació feien referència a patents existents per a seqüències genètiques i vacunes per a altres soques de coronavirus com el SARS-CoV, però no per a la causant de la COVID-19.[352][353] A mitjans de juliol de 2021, amb menys de la meitat de la seva població vacunada, les autoritats sanitàries dels EUA publicaren un comunicat que qualificava a la desinformació de greu perill per la salut pública nacional.[354] Amb l'objectiu de detectar automàticament la desinformació relacionada amb les vacunes contra la COVID-19, experts informàtics dels EUA han desenvolupat un mètode experimental basat en la predicció d'enllaços en gràfics.[355]
Referències
Bibliografia
- Koff, Wayne C.; Schenkelberg, Theodore; Williams, Tere; Baric, Ralph S.; et al Development and deployment of COVID-19 vaccines for those most vulnerable (en anglès). Sci Transl Med, 2021 Feb 3; 13 (579), pp: eabd1525. PMID: 33536277. DOI 10.1126/scitranslmed.abd1525 [Consulta: 11 juliol 2021].
- Klasse, Per Johan; Nixon, Douglas F.; Moore, John P. Immunogenicity of clinically relevant SARS-CoV-2 vaccines in nonhuman primates and humans (en anglès). Sci Adv, 2021 Mar 19; 7 (12), pp: eabe8065. PMID: 33608249. DOI 10.1126/sciadv.abe8065 [Consulta: 10 juliol 2021].
- Bayat, Maryam; Asemani, Yahya; Najafi, Sajad. Essential considerations during vaccine design against COVID-19 and review of pioneering vaccine candidate platforms (en anglès). Int Immunopharmacol, 2021 Abr 15; 97, pp: 107679. PMID: 33930707. DOI 10.1016/j.intimp.2021.107679 [Consulta: 11 juliol 2021].
- Nagy, Abdou; Alhatlani, Bader. An overview of current COVID-19 vaccine platforms (en anglès). Comput Struct Biotechnol J, 2021 Abr 17; 19, pp: 2508-2517. PMID: 33936564. DOI 10.1016/j.csbj.2021.04.061 [Consulta: 15 agost 2021].
- García-Montero, Cielo; Fraile-Martínez, Oscar; Bravo, Coral; Torres-Carranza, Diego; et al. An Updated Review of SARS-CoV-2 Vaccines and the Importance of Effective Vaccination Programs in Pandemic Times (en anglès). Vaccines (Basel), 2021 Abr 27; 9 (5), pp: 433. PMID: 33925526. DOI 10.3390/vaccines9050433 [Consulta: 11 juliol 2021].
- Arashkia, Arash; Jalilvand, Somayeh; Mohajel, Nasir; Afchangi, Atefeh; et al. Severe acute respiratory syndrome-coronavirus-2 spike (S) protein based vaccine candidates: State of the art and future prospects (en anglès). Rev Med Virol, 2021 Maig; 31 (3), pp: e2183. PMID: 33594794. DOI 10.1002/rmv.2183 [Consulta: 28 setembre 2021].
- Mathieu, Edouard; Ritchie, Hannah; Ortiz-Ospina, Esteban; Roser, Max; et al. A global database of COVID-19 vaccinations (en anglès). Nat Hum Behav, 2021 Maig 10; 5, pp: 947–953. ISSN 2397-3374. DOI 10.1038/s41562-021-01122-8 [Consulta: 6 agost 2021].
- Robinson, Jared; Leclezio, Alexandra; Banerjee, Indrajit. COVID-19: Intranasal and Oral Routes of Vaccination (en anglès). J Lumbini Med Coll, 2021 Maig 10; 9 (1), pp: 1-3. ISSN 2392-4632. DOI 10.22502/jlmc.v9i1.427 [Consulta: 2 octubre 2021].
- Noh, Ji Yun; Jeong, Hye Won; Shin, Eui-Cheol. SARS-CoV-2 mutations, vaccines, and immunity: implication of variants of concern (en anglès). Signal Transduct Target Ther, 2021 Maig 22; 6 (1), pp: 203. PMID: 34023862. DOI 10.1038/s41392-021-00623-2 [Consulta: 18 juliol 2021].
- Lacsa, Jose Eric M.; Cordero, Jr, Dalmacito A. We are here…so where’s the vaccine? Achieving ‘herd immunity’ in the midst of the COVID-19 pandemic (en anglès). J Public Health (Oxf), 2021; Jun 3, pp: fdab195. PMID: 34086967. DOI 10.1093/pubmed/fdab195 [Consulta: 24 juliol 2021].
- Bhat, Amarnath; Browning-McNee, Lea Ann; Ghauri, Kanwal; Winckler, Susan. COVID-19 vaccine confidence project (en anglès). J Am Pharm Assoc (2003), 2021; Jun 11, pp: S1544-3191(21)00273-9. PMID: 34246577. DOI 10.1016/j.japh.2021.06.006 [Consulta: 16 juliol 2021].
- Shimabukuro, Tom T.; Kim, Shin Y.; Myers, Tanya R.; Moro, Pedro L.; et al Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons (en anglès). N Engl J Med, 2021 Jun 17; 384 (24), pp: 2273-2282. PMID: 33882218. DOI 10.1056/NEJMoa2104983 [Consulta: 14 juliol 2021].
- Chen, Musha; Yuan, Yue; Zhou, Yiguo; Deng, Zhaomin; et al. Safety of SARS-CoV-2 vaccines: a systematic review and meta-analysis of randomized controlled trials (en anglès). Infect Dis Poverty, 2021 Jul 5; 10 (1), pp: 94. PMID: 34225791. DOI 10.1186/s40249-021-00878-5 [Consulta: 10 juliol 2021].
- Subbarao, Kanta. The success of SARS-CoV-2 vaccines and challenges ahead (en anglès). Cell Host Microbe, 2021 Jul 14; 29 (7), pp: 1111-1123. PMID: 34265245. DOI 10.1016/j.chom.2021.06.016 [Consulta: 23 juliol 2021].
- Álvarez, Mario Moisés; Bravo-González, Sergio; Trujillo-de Santiago, Grissel. Modeling vaccination strategies in an Excel spreadsheet: Increasing the rate of vaccination is more effective than increasing the vaccination coverage for containing COVID-19 (en anglès). Plos One, 2021 Jul 19; 16 (7), pp: e0254430. PMID: 34280210. DOI 10.1371/journal.pone.0254430 [Consulta: 22 juliol 2021].
- Sen-Crowe, Brendon; McKenney, Mark; Elkbuli, Adel. Disparities in global COVID-19 vaccination rates & allocation of resources to countries in need (en anglès). Ann Med Surg (Lond), 2021; Jul 28, pp: 102620. PMID: 34336193. DOI 10.1016/j.amsu.2021.102620 [Consulta: 4 agost 2021].
- Chavda, Vivek P.; Vora, Lalitkumar K.; Pandya, Anjali K.; Patravale, Vandana B. Intranasal vaccines for SARS-CoV-2: From challenges to potential in COVID-19 management (en anglès). Drug Discov Today, 2021; Jul 29, pp: S1359-6446(21)00331-7. PMID: 34332100. DOI 10.1016/j.drudis.2021.07.021 [Consulta: 28 setembre 2021].
- Pavord, Sue; Scully, Marie; Hunt, Beverley J.; Lester, William; et al. Clinical Features of Vaccine-Induced Immune Thrombocytopenia and Thrombosis (en anglès). N Engl J Med, 2021; Ag 11, pp: 1-10. ISSN 1533-4406. DOI 10.1056/NEJMoa2109908 [Consulta: 12 agost 2021].
- Skelly, Donal T.; Harding, Adam C.; Gilbert-Jaramillo, Javier; Knight, Michael L.; et al Two doses of SARS-CoV-2 vaccination induce robust immune responses to emerging SARS-CoV-2 variants of concern (en anglès). Nat Commun, 2021 Ag 17; 12 (1), pp: 5061. PMID: 34404775. DOI 10.1038/s41467-021-25167-5 [Consulta: 23 agost 2021].
- Iversen, Patrick L.; Bavari, Sina. Extending the interval of COVID-19 vaccine regimens in individuals aged 80 years or older (en anglès). Lancet Healthy Longev, 2021; Ag 19, pp: 1-2. PMID: 34430953. DOI 10.1016/S2666-7568(21)00205-1 [Consulta: 28 agost 2021].
- Niebel, Dennis; Novak, Natalija; Wilhelmi, Jasmin; Ziob, Jana; et al. Cutaneous Adverse Reactions to COVID-19 Vaccines: Insights from an Immuno-Dermatological Perspective (en anglès). Vaccines (Basel), 2021 Ag 25; 9 (9), pp: 944. PMID: 34579181. DOI 10.3390/vaccines9090944 [Consulta: 4 novembre 2021].
- Geng, Qibin; Tai, Wanbo; Baxter, Victoria K.; Shi, Juan; et al. Novel virus-like nanoparticle vaccine effectively protects animal model from SARS-CoV-2 infection (en anglès). PLoS Pathog, 2021 Set 7; 17 (9), pp: e1009897. PMID: 34492082. DOI 10.1371/journal.ppat.1009897 [Consulta: 9 setembre 2021].
- Thura, Min; Sng, Joel Xuan E.; Ang, Koon Hwee; Li, Jie; et al. Targeting Intra-Viral Conserved Nucleocapsid (N) Proteins as Novel Vaccines against SARS-CoVs (en anglès). Biosci Rep, 2021; Set 14, pp: BSR20211491. PMID: 34519332. DOI 10.1042/BSR20211491 [Consulta: 16 setembre 2021].
- Xia, ShengLi; Zhang, YunTao; Wang, YanXia; Wang, Hui; et al. Safety and immunogenicity of an inactivated COVID-19 vaccine, BBIBP-CorV, in people younger than 18 years: a randomised, double-blind, controlled, phase 1/2 trial (en anglès). Lancet Infect Dis, 2021; Set 15, pp: S1473-3099(21)00462-X. PMID: 34536349. DOI 10.1016/S1473-3099(21)00462-X [Consulta: 3 octubre 2021].
- Lara-Puente, Jesús Horacio; Carreño, Juan Manuel; Sun, Weina; Suárez-Martínez, Alejandro; et al. Safety and Immunogenicity of a Newcastle Disease Virus Vector-Based SARS-CoV-2 Vaccine Candidate, AVX/COVID-12-HEXAPRO (Patria), in Pigs (en anglès). mBio, 2021; Set 21, pp: e0190821. PMID: 34544278. DOI 10.1128/mBio.01908-21 [Consulta: 24 setembre 2021].
- Formica, Neil; Mallory, Raburn; Albert, Gary; Robinson, Michelle; et al. Different dose regimens of a SARS-CoV-2 recombinant spike protein vaccine (NVX-CoV2373) in younger and older adults: A phase 2 randomized placebo-controlled trial (en anglès). PLoS Med, 2021 Oct 1; 18 (10), pp: e1003769. PMID: 34597298. DOI 10.1371/journal.pmed.1003769 [Consulta: 12 octubre 2021].
- Gil-Manso, Sergio; Carbonell, Diego; López-Fernández, Luis; Miguens, Iria; et al. Induction of High Levels of Specific Humoral and Cellular Responses to SARS-CoV-2 After the Administration of Covid-19 mRNA Vaccines Requires Several Days (en anglès). Front Immunol, 2021 Oct 4; 12, pp: 726960. PMID: 34671348. DOI 10.3389/fimmu.2021.726960 [Consulta: 23 octubre 2021].
- Carreño, Juan Manuel; Alshammary, Hala; Singh, Gagandeep; Raskin, Ariel; et al. Evidence for retained spike-binding and neutralizing activity against emerging SARS-CoV-2 variants in serum of COVID-19 mRNA vaccine recipients (en anglès). EBioMedicine, 2021 Oct 20; 73, pp: 103626. PMID: 34688034. DOI 10.1016/j.ebiom.2021.103626 [Consulta: 26 octubre 2021].
- Nioi, Matteo; Napoli, Pietro Emanuele. The Waiver of Patent Protections for COVID-19 Vaccines During the Ongoing Pandemic and the Conspiracy Theories: Lights and Shadows of an Issue on the Ground (en anglès). Front Med (Lausanne), 2021 Nov 4; 8, pp: 756623. PMID: 34805221. DOI 10.3389/fmed.2021.756623 [Consulta: 23 novembre 2021].
- Ndeupen, Sonia; Qin, Zhen; Jacobsen, Sonya; Bouteau, Aurélie; et al. The mRNA-LNP platform's lipid nanoparticle component used in preclinical vaccine studies is highly inflammatory (en anglès). iScience, 2021; Nov 20, pp: 103479. PMID: 34841223. DOI 10.1016/j.isci.2021.103479 [Consulta: 1r desembre 2021].
- Ameratunga, Rohan; Woon, See-Tarn; Sheppard, Mary N.; Garland, Jack; et al. First Identified Case of Fatal Fulminant Necrotizing Eosinophilic Myocarditis Following the Initial Dose of the Pfizer-BioNTech mRNA COVID-19 Vaccine (BNT162b2, Comirnaty): an Extremely Rare Idiosyncratic Hypersensitivity Reaction (en anglès). J Clin Immunol, 2022; Gen 3, pp: 1-7. PMID: 34978002. DOI 10.1007/s10875-021-01187-0 [Consulta: 4 gener 2022].
Vegeu també
Enllaços externs
- «Vacuna COVID-19». Canal Salut. Generalitat de Catalunya. [Consulta: 18 febrer 2020].
- SARS-CoV-2 Vaccines and Variants The Rockefeller University. 2021 Feb (en anglès)