Aldehido
Aldehido edo alkanal bat formilo talde bat duen konposatu organiko bat da. Formilo taldea talde funtzional bat da, R-CHO egiturarekin, karbonilo bat zentroan (karbono atomo bat lotura bikoitzarekin oxigeno atomo batekin) hidrogeno bati lotua eta R talde batekin alboan[1]. R talde hori edozein alkilo izan daiteke. R gabeko taldeari aldehido taldea edo formilo taldea izena ematen zaio. Aldehidoak zetonen ezberdinak dira, karboniloa karbono eskeletoaren bukaeran jartzen delako, eta ez bi karbono atomoen artean. Aldehidoak oso ohikoak dira kimika organikoan.
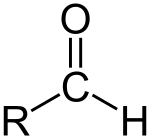

Aldehidorik sinpleena R-ren lekuan hidrogeno atomoa duen formaldehidoa da.
Egitura eta loturak
Aldehidoen zentroan karbono lau bat dago eta karbono horren hibridazioa sp2 da. Beraz, karbono-zentroa dute, oxigenoari loturiko lotura bikoitza eta hirogenoari loturiko lotura bakarra. Karbonoari loturiko hidrogenoaren lotura ez da gehienetan azidoa base konjokatuaren errosonantzia-estabilizazioagatik. Aldehido baten α-hidrogenoa askoz azidoagoa da alkano batena baino. (Aldehidoen Pka 17 inguruan dabil eta alkanoen azidotasuna 50 Pka inguruan)[2].
Azidotzea, formil-zentroaren elektroien erauzketaren kalitatearen edota base konjokatuaren enolatoko anioiak karga negatiboak deslokalizatzearen ondorioz gertatzen da.
Iturri naturalak
Aldehidoak naturan aurkitzen dira. Glukosa-karbohidratoa polihidroxaldehido bat da. Vainillina, banilla zaporea ematen dion aldehidoa, naturan aurki dezakegun beste aldehido bat da.
Industriaren ikuspegitik, aldehido garrantzitsuena formaldehidoa da. Formaldehidoa usain pikantea du eta gas toxiko bat da; gas hau oso erabilia da kantitate handietan industrian plastiko termoestableetako ekoizpenetarako. Formaldehidoa disoluzio batean dagoenean, ur-disoluzio batean, formol edo formalinatzat izendatzen da. Formalina edo formola desinfektatzaile gisan erabiltzen da eta ehungintza-industrian ehun-kontserbatzaile gisa.
Propietateak
Aldehidoen propietateak[3] jakiteko, molekula osoa kontuan hartu behar da. Izan ere, bere propietateak molekularen araberakoak dira. Aldehido txikienak uretan disolbagarriak dira, adibidez formaldehidoa eta azetaldehidoa guztiz disolbagarriak dira. Aldehidoak airean degradatzen dira autodregradazioa deritzon prozesuaren bidez. Industriako aldehido garrantzitsuenak formaldehidoa eta acetaldehidoa dira oligomerizatzeko edota polimerizatzeko portaera konplexua dela eta. Aldehidoek, hidratatzeko joera dute. Oligomeroak, polimeroak eta hidratoak jatorrizko aldehidoekin orekan daude.
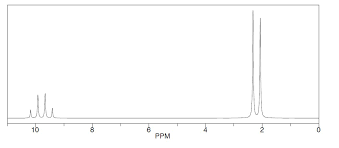
Aldehidoak metodo espektroskopikoekin identifikatzen dira. IR espektroskopia erabiliz, C=O banda bat ageri da 1700 cm-1 inguruan. 1H NMR-ko espektroetan, formil -hidrogeno zentroak δH = 9 ingurukoakoa xurgatzen du,non, espektroaren zati bereizgarria egiten duen. Seinale honek akoplamendu ezaugarri bat erakusten du edozein alfa-karbonotako protoientzat. Kontuan hartu behar dira molekulan dauden beste atomoak. Izan ere, interakzioak direla eta, bandak eskuinerago ala ezkerrerago desplaza daitezke.
- Aldehido batek ematen dituen infragorri seinaleak
- Azetaldehidoaren (etanala) 1H-RMN espektroskopia
Propietate fisikoak
- Karbonilo taldearen lotura bikoitza alde batetik lotura kobalentea eta beste alde batetik lotura ionikoa aurkezten du. Hau karbonilo taldearen polarizazioa dela eta sortzen da. Fenomeno honi erresonantzia deritzo[4].
- Karbonilo bateko alfa-posizioan karbono sp3-ari hidrogeno bat loturik duten aldehidoek isomeria tautomerikoa daukate. Aldehidoak alkohol primarioaren deshidrataziotik lor daitezke, potasio permanganatoa (KMnO4) erabiliz. Zetonak ere alkohol baten desidrataziotik lortzen dira, baina aldehidoak ez bezala, alkohol sekundario batetik. Erreakzioa ahula izan behar da, izan ere, errekzioa bortzitza bada, azido karboxiliko bateraino doa.
- Gehiengo aldehidoak likido-fasean daude (12 karbono arterainoko aldehidoak); 12 karbonotik gorako aldehidoak solido-fasean agertzen dira.
- Aldehido guztiek ura baino dentsitate baxuagoa dute. Aldehido txikienak, formaldehidoa eta azetaldehidoa, uretan disolbagarriak dira. Baina, solubilitatea murrizten doa aldehidoaren tamaina handitzean; hau da, karbono gehiago izan ahala.
- Aldehidoek zetonek baino erreaktibotasun handiagoa dute.
Propietate kimikoak
- Erreaktibitate ona aurkezten dute. Aldehidoek adizio, sustituzio eta kondentsazio erreakzioak dituzte.
- Erreduktore gisa jokatzen dute.
- Aldehidoen eta zetonen erreakzio tipikoena adizio nukleofilikoa da.
Nomenklatura
Aldehidoak, izendatutakoari -ala atzizkia gehietzen izendatzen dira. Aldehido sinpleenak metanala eta etanala dira baina IUPACen izendatze estandarra ez dutenez betetzen beste izen batzuk dituzte. Formaldehidooa eta Azetaldehidoa erabiliagoak dira hurrenez hurren. Hurrengo aldehidoentzat serie homologo hau erabiltzen da: H-(CH2)n-CHO (n = 0, 1, 2, 3, 4, ...).[5][6]
Dialdehidoak, bi aldehido talde-funtzionalekin osatutako molekula organikoak dira. Dialdehidoen nomenklatura idazterakoan, diala idazten da bukaeran, edota dialdehidoa[7][8]. Glioxala da dialdehidorik sinpleena.
| Karbono-zenbakia | IUPACen nomenklatura | Nomenklatura tribiala | Formula | Irakite-puntua (°C) |
|---|---|---|---|---|
| 1 | Metanala | Formaldehidoa | HCHO | -21 |
| 2 | Etanala | Azetaldehidoa | CH3CHO | 20,2 |
| 3 | Propanala | Propionaldehidoa Propilaldehidoa | C2H5CHO | 48,8 |
| 4 | Butanala | n-Butiraldehidoa | C3H7CHO | 75,7 |
| 5 | Pentanala | n-Kaleraldehidoa Amilaldehidoa n-Pentaldehidoa | C4H9CHO | 103 |
| 6 | Hexanala | Kapronaldehidoa n-Hexaldehidoa | C5H11CHO | 100.2 |
| 7 | Heptanala | Enantaldehidoa Heptilaldehidoa n-Heptaldehidoa | C6H13CHO | 48.3 |
| 8 | Oktanala | Kaprilaldehidoa n-OKtilaldehidoa | C7H15CHO | ezezaguna |
| 9 | Nonanala | Pelargonaldehidoa n-Nonilaldehidoa | C8H17CHO | 62.47 |
| 10 | Dekanala | Kaprinaldehidoa n-Dekilaldehidoa | C9H19CHO | 10.2 |
Aldehidoak ordezko gisa agertzen badira, hau da, ez badira talde funtzional garrantzitsuenak, ez dira berdin izendatzen.
Sintesia
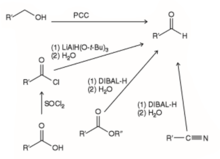
Alkohol primarioen oxidazioa
PCCa erabiliz, alkohol primarioa, aldehidora oxidatzen da.[9]
Alkenoen ozonolisia
Lehenik, ozonolosia egiten da eta, ondoren, erredukzio bat. Agente erreduktoreak: Zn, Pd.[9]

Nitrilo-, ester- eta kloruro-azidoen erredukzioa
- Nitriloen erredukzioa: DIBAL-H erabiltzen da eta gero hidrolisi azidoa egiten da.
- Kloruro-azidoen erredukzioa: Tri-terc-butoxialuminioa eta litio hidruroa erabiltzen da. Erreakzio hau tenperatura hotzean egiten da.
- Esterraren erredukzioa: DIBAL-H erabiltzen da. Erreakzio hau tenperatura hotzean egiten da.[9]
Erreakzioak
Aldehidoak oso erreaktiboak dira eta erreakzio askotan parte hartzen dute. Industria-ikuspegitik, erreakzio garrantzitsuenak: kondentsazioak, adibidez, plastifikatzaileak eta poliolak prestatzekoak direnak eta aldehidoen erredukzioetatik alkoholak lortzeko (batez ere "oxo alkoholak") erabiltzen direnak dira[3][10] .
Oxidazioa
Formilo taldea erraz oxidatzen da dagokion talde karbonilikora (-COOH). Industrian gehien erabilitako oxidatzailea, oxigenoa edo airea da. Laborategian, berriz, KMnO4 edo Ag2O erabiltzen da medio basikoan. Hauetaz gain, kromo (Vl) oxidoa, azido kromikoa edota azido nitrikoa erabiltzen dira[3].
Adizio nukleofilikoa
Nukleofilikoak erraz gehitzen dira karbonilo taldean. Produktuan, talde karboniloan dagoen karbonoa sp3 hibridazioa izatera pasatzen da. Beraz, nukleofilora elkartzen da eta ondorioz oxigenoa protonatu egiten da[3].
Hidrogeno-zianuro adizio-erreakzioa
Aldehidoak hidrogeno zianuroarekin erreakzionatzen du zianohidrina emateko[3].
Amina primarioen eta sekundarioen adizio-erreakzioa
- Amina primarioekin erreakzionatzen du (medio azidoan) imina emateko.
- Amina sekundarioekin erreakzionatzen du (medio azidoan) enamina emateko[3].
Erredukzioa
Hidruro metalikoen erredukzioen metodoa erabilgarriena da. Alkoholak lortzen dira.
- LiAlH4 . Hurrengo konposatuen erredukzioa egiten du: aldehidoak, zetonak, azidoak (eta deribatuak), nitriloak eta alkil haluroak. Erreakzioetan eterra erabiltzen da disolbente bezala.
- NaBH4 : Hurrengo konposatuen erredukzioa egiten du: aldehidoak eta zetonak. Disolbente bezala etanol erabiltzen da[3].

Clemensen erredukzioa
Medio azidoan gertatzen da, Zn amalgama erabiliz[3].

Witting erreakzioa
Aldehido eta iluro-fosforoarean arteko erreakzioak alkeno bat ematen du[3].

Hidrogenazioa
Aldehidoaren hidrogenazioak alkohola ematen du. Katalizatzaile bezala Pt, Ni edo Pd erabiltzen da[3].

Erabilerak
Aldehidoak hurrengo erabilerak izan ditzake[11]:
- Plastikoen fabrikazioan, erretxina eta produktu akrilikoak[12].
- Argazki-industrian erabiliak dira koloratzaile eta lehergai bezala (pentaeritrola, TNPE,..).
- Antiseptiko eta iraunarazle bezala oso ondo funtzionatzen dute.
- Herbizida, fungizida eta pestizida bezala erabili ohi dira.
- Bulkanizazioaren azelerazioan.
- Janari-industrian eta perfumeria-industrian.
- Ehungintza-industrian eta industria farmazeutikoan.
- % 40ko ur-disoluzioari formol deitzen diogu. Egurra,larrua etab. kontserbatzeko erabiltzen da.
- Etanala ispiluak fabrikatzeko erabiltzen da.
Dialdehidoak
Dialdehidoa bi aldehido-talde dituen konposatu kimiko organikoa da. Dialdehidoen nomenklaturak dial bukaera edo, batzuetan, dialdehidoa du. Dialdehido alifatiko laburrei diazidoa deritze batzuetan, zeinetatik baitatoz. Adibide bat butanediala da, succinaldehido (azido succinikotik) ere esaten zaiona.
Biokimika
Aldehido batzuk aldehido-deshidrogenasaren entzimen substratuak dira, gorputzean aldehidoak metabolizatzen dituztenak. Badira zenbait aldehidori lotutako toxikotasunak, gaixotasun neurodegeneratiboekin, bihotzeko gaixotasunekin eta minbizi mota batzuekin zerikusia dutenak[13].
Aldehidoen adibideak
- Formaldehidoa
- Azetaldehidoa
- Propionaldehidoa
- Butiraldehidoa
- Isovaleraldehidoa
- Bentzaldehidea
- Cinamaldehidoa
- Bainilina
- Tolualdehidoa
- Furfurala.
- Erretinaldehidoa
- Glicolaldehidoa
Dialdehidoen adibideak
- Glioxal
- Malondialdehidoa
- Succinaldehidoa
- Glutaraldehidoa
- Phthalaldehidoa