緑内障
緑内障(りょくないしょう、英: glaucoma )は、目の病気の一種。青底翳(あおそこひ)とも呼ばれる。
| 緑内障 | |
|---|---|
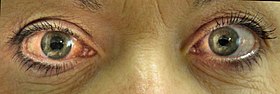 | |
| 右眼の急性閉塞隅角緑内障 | |
| 概要 | |
| 診療科 | 眼科学 |
| 分類および外部参照情報 | |
| ICD-10 | H40-H42 |
| ICD-9-CM | 365 |
| DiseasesDB | 5226 |
| MedlinePlus | 001620 |
| eMedicine | oph/578 |
| MeSH | D005901 |
概説
緑内障は網膜神経節細胞が死滅する進行性の病気であり、特徴的な視神経の変形と視野異常(視野欠損)を呈する。一度喪失した視野は回復させることが出来ないため、失明の原因になりうる。日本では、最近になって糖尿病網膜症を抜いて1番目の失明の原因となっている[1]。視野狭窄は自覚されないうちに末期症状に至ることも多く、発見には定期的な(眼を検査対象に含めた)健康診断が必須である。
かつては、眼球の中の圧力である眼圧が高いことが原因と考えられていたことから、眼圧を下げることで視野障害の進行を停めるという方法をとる。眼圧を30 %低下させることにより、正常眼圧緑内障において80 %の患者において視野障害の進行が停止したという報告もある[2]。しかし、眼圧が正常範囲であっても緑内障に罹患している患者が多いことが確認され、視神経乳頭の脆弱性が緑内障の原因として考えられている。
原因

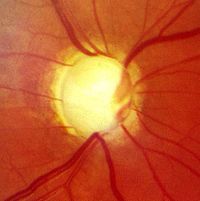
緑内障の定義は「視神経変化・特徴的視野変化を有し、眼圧下降により進行を防止できる病気」である。何らかの原因により視神経乳頭内の篩状板が変形し、その中を通過する視神経線維が物理的に圧迫されると逆行性軸索輸送による神経栄養因子の輸送が阻害されて神経節細胞が死滅する。視神経線維の脱落に伴い、その部分に該当する網膜の感度低下から視野欠損が起こり、病気の進行に伴い視神経乳頭の変形と視野異常が進行する。
視神経乳頭が変形・陥没していく原因はいまだ明らかではないが、眼圧の物理的圧迫によるという眼圧説 (機械説) や、正常眼圧緑内障患者に片頭痛やレイノー現象が多いことから視神経乳頭部の血流異常が関与しているという血流説、緑内障を引き起こす遺伝子異常がいくつか報告されていることから視神経の脆弱性が緑内障の発症に関わっているという説などが提唱されている。その他にも、自己免疫疾患の関与、アルツハイマー病、パーキンソン病などの神経変性疾患との関与、ヘリコバクター・ピロリ感染と緑内障の関与なども報告されている。また緑内障患者は脳脊髄圧が低いという報告がある。現在のところ緑内障治療に有効なエビデンスは眼圧下降のみである。
2011年、大阪大学大学院医学系研究科の山下俊英らは、マウス実験において神経細胞の軸索中に存在する軸索の再生を阻害する因子と結合するPIR-Bたんぱく質の働きを分析し、神経細胞の軸索の再生を妨げるメカニズムを明らかにしたと発表した[4]。神経節細胞の破壊メカニズムの解明により視神経の損傷に対する新たな分子標的治療薬の開発につながる可能性がある。
2015年8月、福井大学の稲谷大らの研究チームは、眼圧の高いマウスの視神経においてミトコンドリアの輸送が止まる状態をレーザー顕微鏡で確認し、これまで解剖から栄養の輸送が止まると推測されていた現象を生体で実際に確認することに成功した[5]。
グルタミン酸ナトリウム原因説
2002年、弘前大学の研究グループは化学調味料として広く使われているグルタミン酸ナトリウムを過剰摂取させたマウスにおいて網膜ニューロン層の厚さが著しく薄くなっていることを認め、これと正常のマウス群と比較し統計的な有意差を確認している。同チームによれば日本において正常圧緑内障が多い原因が、日本の食生活においてグルタミン酸ナトリウムを多く摂取していることが原因であることを推測している[6][7]。
なお現在国内では食品添加物表示では「グルタミン酸ナトリウム」との直接表示を避け「調味料(アミノ酸等)」という表記で代替されている場合が多いので、成分確認の際は注意が必要である[8]。
禁忌薬
抗コリン作用を示す薬剤については服用に際して慎重になる必要がある[9]。例えば下痢止めに用いられる鎮けい薬「正露丸」においては製薬会社の異なる類似の商標で、緑内障に対し副作用を示すロートエキス[10] を成分とする製品とそうでない製品が販売されている[11]。
禁忌
疫学

日本では、以前は40歳以上の人の30人に1人が罹患しているといわれていたが (1988年、1989年)、2000年の疫学調査からは40歳以上の17人に1人、2003年の疫学調査からは40歳以上の20人に1人が罹患しているという結果が報告されている[13] (日本緑内障学会 2000年、2004年)。有病率は年齢とともに上昇し、40歳代では2 %であるが70歳代になると10 %を超える (2004年)。日本国内で治療中の患者は約30万人 (2002年の厚生労働省患者調査)。潜在患者数は400万人ともいわれる (2000年)。
- 緑内障発症の危険因子として明らかなもの[14]
- 加齢
- 眼圧
- 緑内障の家族歴
- 発症者の傾向
- 緑内障を合併しやすい病態・疾患
ただし糖尿病に関しては緑内障に保護的に働くとの報告もあり、緑内障専門医間でも議論が分かれる[15]。
生理学的所見
運動により眼圧は一時的に下降する[21]。
ヒト以外の動物
症状
多くの緑内障は視野の相補性 (視野欠損が生じても反対の目が情報を補うため視野欠損に気づきにくい) や視野の補完性 (視野欠損部があっても視中枢が欠損部周囲の情報から欠損部を補完するため視野欠損に気づきにくい) のために自覚症状に乏しく末期に至るまで気づかれにくい。そのために初期の緑内障は他の症状を訴えて受診した際に偶然発見されたり、健康診断の眼底検査で発見されたりすることが多い。新聞広告の簡易検査表やTVのノイズ画面などで簡便な検査をしてみるのも一考である。眼圧が著しく上昇する場合には一時的な目のかすみ感 (例えば起床後1〜2時間のあいだ目が白く霞む日が時々あるなど) や光のにじみ、頭痛を自覚することもあるが稀である。それに対して急性隅角閉塞症や急性閉塞隅角緑内障は突然の激しい眼痛や頭痛、視力低下を生じる。
 |  |
|---|---|
| 正常な視野 | 視野狭窄が生じた視野のイメージ例 |
2020年の報告によると、50歳以上における世界全体の失明の原因として緑内障が 360万件を占め、白内障(1520万件)に次ぐ2位だった。これは、屈折異常の矯正不足(230万件)、加齢黄斑変性(180万件)、糖尿病網膜症(86万件)を上回る[22]。
分類
隅角の構造によって閉塞隅角緑内障と開放隅角緑内障の2つに分けることが多い。また発症の誘因から3つのタイプに分けられる。診断名には、構造による分類と誘因による分類の2つを組み合わせて「原発開放隅角緑内障」などと使うことがある。原発性の場合は省略することもある。
眼圧の値、視野障害の有無からも分けることができる。
閉塞隅角緑内障

- 急性閉塞隅角緑内障
- 房水排出部である隅角が比較的短期間にふさがり、房水の排出能が急激に低下することにより眼圧が急激に上昇することで発生する。突如激しい頭痛、目の痛み、腹痛、嘔吐などの症状が出る。対処が遅れると一晩でも失明の危険がある。激しい頭痛などによる症状から脳疾患などと疑われやすく、診断が遅れることが多い。緊急の場合には、外科的手術を必要とすることもある。
- 中年以降の遠視の女性に好発する。通常、前房深度が狭くなる夜間~明け方に発症しやすい。視神経障害を生じると閉塞隅角緑内障となる。
- 慢性閉塞隅角緑内障
- 房水排出部である隅角が (部分的に) ふさがっている。自覚症状に乏しく、徐々に視野狭窄の症状が起きる。
- 続発閉塞隅角緑内障
- ぶどう膜炎続発緑内障、血管新生緑内障、角膜移植後緑内障、小眼球症、悪性緑内障などがある。
開放隅角緑内障
- 原発開放隅角緑内障
- 緑内障に一番多いタイプで、約90 %を占める。
- 狭義の原発開放隅角緑内障は隅角は開いているが、房水排出部が詰まって流れが悪くなり、発生すると考えられている。症状は慢性型閉塞隅角緑内障と同じで、自覚症状に乏しく、徐々に視野が減少する。
- 正常眼圧緑内障
- 原発開放隅角緑内障の中で無治療時の眼圧が21 mmHg以下と正常範囲であるものを正常眼圧緑内障と呼ぶ。当初は眼圧が低いのに緑内障であることから低眼圧緑内障とも呼ばれていたが、眼圧が正常範囲であることから正常眼圧緑内障の名が定着した。日本では全緑内障の72 %を占める最も多い病型である (多治見スタディ)。正常眼圧緑内障と眼圧が高い (狭義の) 原発開放隅角緑内障を厳密に鑑別診断するためには、眼圧が24時間正常範囲内にあることの確認や眼圧の評価の際に角膜厚を補正する必要があるとされていた。現在では正常眼圧緑内障と眼圧が高い原発開放隅角緑内障とを区別することに臨床的意義はないと考えられるようになり、両者を併せて (広義の) 原発開放隅角緑内障と呼ぶ。
- 続発開放隅角緑内障
- 糖尿病網膜症・網膜中心静脈閉塞症・眼虚血症候群等に伴う血管新生緑内障、ぶどう膜炎に伴うもの、ステロイドによる緑内障、ポスナーシュロスマン (Posner-Schlossman) 症候群、偽落屑症候群、色素緑内障、アミロイドーシス
発達緑内障
房水の出口である隅角に先天異常があることで発症する緑内障。乳児期に発症する早発型はかつて先天緑内障と呼ばれていたもので、黒目 (角膜) が大きくなる「牛眼」や角膜の混濁により発見されることが多い。明るいところをいやがる羞明や流涙を訴えることもある。発見次第早期に手術を必要とすることが多い。他に、異常の程度が軽いために発症時期が遅れる遅発型や、マルファン症候群やスタージー・ウェーバー症候群のように隅角以外の先天異常を伴う発達緑内障もある。
緑内障関連病名
- 高眼圧症
- 眼圧が21 mmHg以上でも緑内障性変化を認めない場合には高眼圧症と診断される。角膜厚が厚く見かけ上眼圧が高く測定される場合や、視神経乳頭の眼圧への抵抗力が強い場合には高眼圧症と診断されたまま生涯緑内障にならない。しかし高眼圧症の一部には何年かのちに緑内障性変化が現れることがあり、この場合は緑内障の前駆状態であったと考えられる。眼圧が25 mmHgを越える高眼圧症眼は緑内障になりやすいと報告されている。
- 視神経乳頭陥凹
- 緑内障性視神経障害が進行すると視神経乳頭縁の狭細化や視神経乳頭陥凹の拡大など特徴的な変化が現れる。こうした視神経乳頭の異常があるにもかかわらずに視野異常を認めないときに視神経乳頭陥凹と呼ばれる。視神経乳頭異常が視野異常に先行するために緑内障の前駆状態ともとらえられる。一般的な健康診断や人間ドックでは視野検査を行わないので、この病名で精密検査 (視野検査など) を促す。
- 偽緑内障
- 緑内障と紛らわしい視神経乳頭や視野異常を示すが緑内障ではないもの。通常は治療しなくても進行しない。視神経疾患や頭蓋内疾患、大量出血など病気で起こることもあれば、視神経低形成など先天的な場合もある。丁寧な問診や詳細な検査で区別がつくこともあるが、進行の有無を確認するために年余にわたる経過観察が必要になることも多い。
- 視神経部分低形成
- 視力は正常で部分的な視野欠損を示すが視野欠損を自覚することは少ない。視神経部分低形成 (英: segmental optic disc hypoplasia )はコンタクトレンズの検診で発見されることが多く、若年者の視野欠損の鑑別診断の一つとして重要である。視野欠損の特徴としてマリオット盲点へ向かう相対暗点の少ない扇形に外方に広がる楔状視野欠損が認められる。その多くは緑内障性視野欠損の特徴とは異なることから鑑別が可能である。下方の視野欠損を呈する視神経乳頭上方低形成 (英: superior segmental optic disc hypoplasia: SSOH) は、(i) 視神経乳頭上鼻側のrimの菲薄化、(ii) double ring sign、(iii) rim菲薄部に一致する鼻上方の幅広い神経線維層欠損を3徴とする。以前は視神経低形成の頻度はあまり高くないと考えられていたが多治見スタディのデータより SSOH の頻度が以前考えられていたよりも高いことが示された。
検査
検査は眼圧検査、隅角検査、眼底検査、視野検査、視神経乳頭等の形状解析などが行われる。
眼圧検査
眼の内部の圧である眼圧を測定する。眼圧を下げることが緑内障の治療となるので治療状況を把握するための基礎的な検査である。検査機器は接触型と非接触型の二つに分けられ、接触型としてゴールドマン眼圧計やパーキンス眼圧計、トノペンなどがあり、非接触型として圧縮空気を吹き付けるノンコンタクトトノメーターがある。前者は表面麻酔薬を用いて麻酔後、黄色い色素をつけてから施行する必要があるが後者よりも測定精度が高い。またその施行には熟練を要する場合もある。
眼圧には日内変動があり病院受診時の眼圧が代表的な眼圧とは限らない。外来での眼圧が低いにもかかわらず緑内障の進行が止まらない場合には、他の時間帯に眼圧が上がっていることを疑って24時間の眼圧の推移を測定する場合がある。日内変動の他に日々変動や季節変動もある。また体位による眼圧の変動も知られており、仰臥位にて眼圧が上昇する傾向にある。
一般に角膜が平均より厚い人は眼圧が実際よりも高く測定され、逆に角膜が元々薄い人や近視矯正手術で薄くなっている人は、眼圧が実際よりも低く測定される。他にも角膜の病気があると正確な眼圧測定ができずに緑内障の病状把握が困難になることがある。高眼圧症と診断される人の中には角膜が厚いだけで実際の眼圧は高くない場合もある。眼圧の補正は、補正後眼圧 = 実測眼圧 - 0.012 × [角膜厚 (μm) - 520] で計算される。
隅角検査
緑内障の病型を定めるために行う。表面麻酔を行い検査用のレンズを角膜に乗せて水の出口である隅角の状態を検査する。隅角の開大度や形態異常、色素沈着、隅角後退、新生血管、虹彩前癒着などの有無を確認する。血管新生緑内障の隅角新生血管や落屑症候群のサンパオレージ線、ポスナーシュロスマン症候群の健眼よりも薄い色素沈着沈着など特徴的な所見も多い。病型によっては進行度合いによって隅角の状態も変わるので検査を繰り返す場合もある。
眼底検査
視神経乳頭陥凹の度合い、網膜神経線維層欠損 (英: nerve fiber layer defect) の有無、乳頭出血の有無、乳頭周囲脈絡網膜萎縮 (英: peripapillary atrophy) 等を診る。
視野検査
緑内障を発症すると視野に異常が現れ、ビエルム領域と呼ばれる中心から15度〜30度の範囲に視野異常が初発することが多い。通常末期になるまで中心視野は保たれることが多いため視野異常を自覚しにくい。しかし中心視野が損なわれると視力は急激に低下する。
- ゴールドマン視野計 (GP)
- 指標を外から中心へ向かって動かし、見えた位置をつなげて視野の形を決定する検査で動的視野検査と呼ばれる。視角90度まで測定できるので視野全体の形を把握するのに適している。検者の技量に依存し異なる検者間での比較が困難であり、また定量性に欠けるという欠点がある。
- ハンフリー視野計 (HFA)、オクトパス視野計
- 異なる明るさの光を提示して、光が見える最小の輝度からその位置の感度を決定する検査で静的視野検査と呼ばれる。緑内障性変化のでやすい中心視角30度で検査をおこなうことが多い。ゴールドマン視野計よりも初期緑内障の検出感度が高い。初期から中期の緑内障の経過観察に適し、また定量性に優れる。末期となり固視点が小さい場合も中心10度の検査で経過観察を行うことができる。短時間に行う設定も存在し簡便に施行することができる。また動的視野も測定するプログラムが開発されている。
- FDT (英: Frequency Doubling Technology Perimetry)
- ハンフリー視野計やオクトパス視野計では検出できない、より早期の緑内障発見をめざして開発された。異なる輝度の縞模様を反転させ、そのちらつきが見える最小の輝度から感度を決定する。前2機種に対する明らかな優位性は確認されていない。
画像解析検査
視神経乳頭や視神経線維層の形状解析により緑内障の進行度合いを推し量る
治療
治療法としては、進行を遅らせる対症療法と失った視神経を再生させる根本治療が考えられるが、臨床では対症療法しか選択肢がなく、視神経再生技術は研究段階である。
緑内障治療は、眼圧を下げて視神経を保護することである。具体的に眼圧を下げる治療方法として点眼薬、内服薬、点滴療法、レーザー手術、外科手術がある。視野欠損が小さい発症初期には点眼薬により眼圧を下げて経過を追うが点眼薬による眼圧下降には限界がある。初診時より大きな視野欠損があり十二分に眼圧を下げなければいけない場合や、点眼治療にもかかわらず進行する場合には、外科手術を含む点眼以外の治療が必要となる。失った視野を取り戻す方法は無い。
薬剤による治療

プロスタグランジンとβ遮断薬の配合剤
緑内障点眼治療薬として現在よく使われているのはプロスタグランジン関連薬、交感神経遮断薬、炭酸脱水酵素阻害薬、α2受容体作動薬の4種類であり、眼圧下降が良好なプロスタグランジン関連薬が第一選択薬となる場合が多い。第二選択薬は交感神経遮断薬、炭酸脱水酵素阻害薬のいずれかが選ばれる場合が多い。実際には個人個人によって眼圧下降の必要度の多寡、性別、年齢、既存の全身疾患の有無などを総合的に考慮して第一選択薬、第二選択薬は選ばれる。病型によっては副交感神経刺激薬が選択される場合もある。また2種類の薬剤を配合した合剤も使用されている。
- プロスタグランジン関連薬

プロスタグランジンF2α
- 日本ではプロスト系のラタノプロスト、トラボプロスト、タフルプロスト、プロスタマイド系のビマトプロスト、プロストン系のイソプロピルウノプロストンが上市されている。眼圧下降効果に関してはプロスト系がほぼ同等、ビマトプロストはプロスト系と同等あるいはやや眼圧下降効果に優れ、ウノプロストンは一段落ちるとする報告が多い。眼圧下降機序はぶどう膜強膜流出路からの房水流出の上昇とされている。プロスタグランジン関連薬は、全身の副作用が少ない反面、眼局所の副作用を有して眼瞼(まぶた)、虹彩の色素沈着やまつげが濃くなるのはほぼ必発であり、炎症や黄斑浮腫を引き起こす可能性も指摘されている。また眼圧下降効果の小さいノンレスポンダーの存在も知られている。プロスタグランジン関連薬に関しては、ノンレスポンダーを除外するために片眼トライアルと言われる片目だけに治療して無治療眼との治療効果を比較する方法が知られているが、片眼トライアルは長期的な眼圧下降を反映しないという前向き研究が近年報告されている。
- 交感神経遮断薬
- β遮断薬としてマレイン酸チモロール、ゲル化チモロール、塩酸カルテオロール、ゲル化カルテオロール、β1選択的遮断薬として塩酸ベタキソロール、αβ遮断薬として塩酸レボブノロール、ニプラジロール、α1遮断薬として塩酸ブナゾシンが上市されている。眼圧下降機序は毛様体における房水産生の抑制である。β遮断薬はかつては治療の第一選択薬であったが、就眠時眼圧を下げる効果が弱いこと、長期使用で効果が減弱すること、全身的な副作用が多く重篤であることからその座をプロスタグランジン関連薬に譲ることとなった。眼圧下降効果に関してはマレイン酸チモロール、ゲル化チモロール、塩酸カルテオロール、塩酸レボブノロール、ニプラジロール間では眼圧下降効果に大きな差はないとされている。塩酸ベタキソロールに関しては、チモロールと比較しやや眼圧下降効果が低いとされているが、ベタキソロールにおいても点眼開始12ヵ月後にはチモロールやカルテオロールと遜色のない眼圧下降効果を示すという報告もある。β遮断薬・αβ遮断薬・β1遮断薬では多くの全身副作用が報告されており洞徐脈、2度以上の房室ブロック、コントロール不十分な心不全などがある患者では禁忌である。呼吸器系への影響としては、β2遮断作用により気管支平滑筋が収縮するので、喘息患者や慢性閉塞性肺疾患(COPD)などでは気道閉塞が誘発される危険性がありβ遮断薬・αβ遮断薬は禁忌である。カルテオロールには内因性交感神経刺激作用があり血圧低下が少ないとされている。ブナゾシンはα1遮断薬であり局所・全身副作用が少ない反面、眼圧下降効果もやや劣るとされている。
- 炭酸脱水酵素阻害薬
- 炭酸脱水酵素阻害薬としてはドルゾラミド塩酸塩、ブリンゾラミドが上市されている。眼圧下降機序は房水産生の抑制である。炭酸脱水酵素阻害薬はしみる、かすむ等の眼局所副作用を有するものの全身副作用が少ない。単剤での眼圧下降効果は交感神経遮断薬に劣るもののラタノプロストとの併用では交感神経遮断薬と同等の眼圧下降効果を示すという報告もある。両者とも単剤投与では2回点眼よりも3回点眼が眼圧下降の点で優れるという報告が多いが、プロスタグランジン関連薬との併用では2回点眼と3回点眼とで差がないとも報告されている。プロスタグランジン関連薬との併用時にはβ遮断薬と眼圧下降効果に差はなく、就眠時の眼圧を下げる効果はβ遮断薬より強いため第2選択薬として選ばれることも少なくない。
- α2受容体作動薬
- α2受容体作動薬としてはブリモニジン酒石酸塩が上市されている。眼圧下降機序は房水産生抑制ならびにぶどう膜強膜流出路を介した房水流出の促進である。眼圧下降効果は単剤ではβ遮断薬とほぼ同等だが、トラフの眼圧下降効果が弱い可能性が指摘されている。プロスタグランジン関連薬にβ遮断薬、炭酸脱水酵素阻害薬、α2受容体作動薬を追加投与した際の眼圧下降効果に関してはほぼ同等という報告と、α2受容体作動薬がトラフでやや劣るとする報告がある。ブリモニジン酒石酸塩は、様々な基礎研究において神経を保護する効果が報告されていたが、The Low-pressure Glaucoma treatment studyという正常眼圧緑内障に対する無作為化比較試験において眼圧非依存的な神経保護効果がある可能性が2011年に報告された。
- Rhoキナーゼ阻害剤
- 2014年に発売された比較的新しい薬剤。結膜充血を高率に来すために第一選択とはならないが、プロスタグランジンやβブロッカーなどの追加しても上乗せ効果が得られる。詳細は「リパスジル」を参照
- カルパイン阻害剤
- 薬物治療の方針
- プロスタグランジン関連薬を点眼しても緑内障性視野障害が進行する場合には点眼薬の追加を考慮する。ただしノンレスポンダーであることで充分な眼圧下降が得られていない可能性がある場合には、プロスタグランジン系薬の他剤への切り替えを行うこともある。ただし、眼圧には日内変動、季節変動がありノンレスポンダーの評価は困難である場合がある。追加点眼薬としては具体的にはβ遮断薬の追加、もしくは炭酸脱水酵素阻害薬の追加を考慮する場合が多い。両者はプロスタグランジン点眼薬との併用において眼圧下降効果は同等であるという報告が多い。炭酸脱水酵素阻害薬には少ない全身的副作用や就眠時眼圧の下降という長所と一日二回もしくは三回点眼が必要、しみる、霞むといった眼局所副作用が多いという短所があり、一方、β遮断薬には一日一回点眼で充分な眼圧下降効果を持つ薬剤があるためアドヒアランスが良好、局所の副作用が少ないといった長所と重篤な全身的副作用と就眠時眼圧下降が不十分といった短所がある。加えて治療を受ける個人の眼圧下降の必要度の多寡、性別、年齢、既存の全身疾患の有無などを総合的に考慮して第一選択薬、第二選択薬が選ばれる。
- 2剤点眼下で緑内障性視神経症が進行する場合には3剤目の追加点眼を考慮する。3剤目の追加投与ではいずれの追加においても眼圧下降に大きな違いはないとされている。
- 4剤目の追加点眼の効果は限定的である。角膜上皮障害の増加などの副作用の増加や、アドヒアランスの低下が考えられるため4剤目の追加点眼は慎重に考慮する必要がある。4剤目の追加を行わずに次の治療に移行することも多い。
- その他の点眼治療
- プラトー虹彩など一部の病型ではピロカルピンなどの副交感刺激薬による縮瞳が有効であることもある。
- 内服治療と点滴治療
- 点眼薬を多剤使用しても眼圧降下が十分ではない場合にはアセタゾラミドなどの炭酸脱水酵素阻害薬の内服薬を併用する場合がある。副作用として四肢末端のしびれ感、食思不振、異味感などがあげられるが尿路結石、骨髄抑制などの重篤な副作用もあるため通常は長期に使用しない。手術までの短期間の眼圧を抑えるため、手術を希望しない場合、既に複数回の手術がなされており手術による効果が望みにくい場合などに使用される。
- マンニトールやグリセリンなどの高張浸透圧薬による点滴治療は一過性に眼圧を下げる必要がある場合に選択される。
- 充分に眼圧が下がっているにもかかわらず緑内障性視野障害の進行が止まらない場合がある。その際にはカルシウム拮抗薬を内服して視神経保護効果を期待することもある。同じく神経保護効果のある点眼や血流改善効果のある点眼を併用することもある。
- 妊娠・授乳と緑内障
- 妊娠・授乳期における緑内障治療薬使用の安全性は明らかではない。プロスタグランジン系薬は胎盤を通過することが知られており、妊娠中の使用は避けられる場合が多い。交感神経刺激薬は比較的安全とされている。交感神経遮断薬の使用により胎児に低心拍数、不整脈が見られたとの症例報告がある。しかし交感神経遮断薬使用群と比較し、非交感神経遮断薬使用群に有意に低出生体重児が多いという報告もある。副交感神経刺激薬により流産や早産が誘発されるとの報告がある。動物実験では炭酸脱水酵素阻害薬の大量投与による催奇形性が報告されている。妊娠により眼圧は下降するとされている。交感神経遮断薬は母乳への移行が多いため授乳期の使用は避けられることが多い。
レーザーによる処置
- レーザー虹彩切開術
- レーザーで虹彩周辺部に小孔をあけて隅角が閉じないようにする治療。急性あるいは慢性閉塞隅角緑内障が発症した場合に薬物療法に優先して/並行して選択される。レーザーでは虹彩切開できない症例に対しては「観血的虹彩切除術」か「白内障手術」を施行する。最大の合併症は角膜内皮細胞の減少で、切開術施行後数年経ってから角膜内皮細胞の減少により水疱性角膜症に伴う角膜混濁が起こることがあり、角膜移植や角膜内皮移植が必要になる。
- レーザー線維柱帯形成術 (ALT; 英: Argon Laser Trabeculoplasty, SLT; 英: Selective Laser Trabeculoplasty )
- 低エネルギーの短パルスのレーザーを、房水の流出経路である繊維柱帯に照射する。すると体内の自然治癒反応で房水の排出機能が改善し、眼圧を下げる。治療の所要時間は数分。入院が不要など負担は少ないが、施術された中で眼圧が下がるのは約70%であり、効いたとしても眼圧降下作用は小さく、時間が経つにつれてその効果は減弱する。したがって外科手術に代わるものではない。手術を希望しない、高齢、点眼するのを忘れがち、副作用のため点眼が困難な場合などに行われる。SLTは効果が減弱したときに再度施術できる。
外科手術
- 線維柱帯切開術 (トラベクロトミー)
- 線維柱帯を切り開く手術で生理的房水流出路の機能回復を目的としている。線維柱帯が眼圧上昇の主因となっている場合には根治的治療となりうる。開放隅角緑内障に対する線維柱帯切開術後の平均眼圧は薬物療法を併用しても10台後半である。術後の合併症は少ない。合併症としては、前房出血、一過性眼圧上昇は頻度が高く、前房出血は必発である。稀な合併症として早期穿孔、毛様体剥離、デスメ膜剥離などがある。早発型発達緑内障 (特に生直後) には有効である。ステロイド緑内障、落屑緑内障には比較的有効であるとされ、線維柱帯切除術との比較が近年行われているが、眼圧下降のみを評価すると線維柱帯切除術が有効であるとする報告が多い。
- 成人に対する線維柱帯切開術は日本以外ではほとんど行われていない。
- 線維柱帯切除術 (トラベクレクトミー、濾過手術ともいわれる)
- 虹彩に小さく開口部を作るとともに強膜に水が流れる通路を造り、後房から強膜外 (眼球外) へと房水を排出する。眼圧降下作用が大きく、効果の長期的な持続が見込める。創傷治癒を抑制するためにマイトマイシンC (抗がん剤性抗生物質) を併用する場合が非常に多い。 (かっては5-フルオロウラシル (5-FU代謝拮抗剤) を使用していた。) 原発開放隅角緑内障に対する緑内障手術の成績は、緑内障手術後平均3.8年 (最長8年) の最終観察時点での眼圧が20 mmHg以下であったものが76 %、15 mmHg以下であったものが59 %であった。合併症としては結膜からの房水漏出、脈絡膜剥離、悪性緑内障、駆出性出血、線維柱帯切除部閉鎖、濾過胞機能不全、乱視、視力喪失、濾過胞からの房水漏出、低眼圧黄斑症、感染性眼内炎、白内障、濾過胞の角膜上への張り出しなどの可能性がある。末期緑内障に対する手術では中心視野を喪失する場合もある。前房に穿孔しない非穿孔性線維柱帯切除術という変法は術直後の合併症を軽減できるものの眼圧コントロールを維持することが原法よりも困難であり適応は限られる。また初回の線維柱帯切除術と比較すると2回目以降の線維柱帯切除術は有意に術後成績が下降する。近年、円蓋部基底結膜弁線維柱帯切除術によりろか胞感染症の予防効果を評価する大規模な前向き研究が緑内障学会を主体に行われたが、円蓋部基底結膜弁と輪部基底結膜弁線維柱帯切除術の間にろ過法感染の発生に関して明らかな差はなかった。また2012年4月からエクスプレスという緑内障フィルトレーションデバイスが保険収載され用いられている。
- 羊膜移植併用線維柱帯切除術
- 難治緑内障に対し羊膜を併用した線維柱帯切除術が行われる場合があり、その有効性がいくつかの施設から報告されている。
- インプラント手術
- 難治緑内障に対する線維柱帯切除術に代わる治療法として注目されている。海外では線維柱帯切除術との有効性を比較する無作為化比較試験が行われており、ある程度良好な結果が得られている。日本では2012年4月からバルベルト緑内障インプラントが保険収載された。インプラントを眼内に挿入することにより房水流出促進径路を形成することで眼圧コントロールを可能にする。シリコーン製のプレートとチューブから成り、チューブを介して房水を眼内から上強膜へ排出させて眼圧を下降させる。
- 隅角癒着解離術
- 広い範囲に虹彩前癒着がある閉塞隅角緑内障にたいして虹彩癒着を剥離することで眼圧を下げる手術。生理的房水流出路を用いるので眼圧降下には限界があり、より低い眼圧を求める場合には線維柱帯切除術が行われる。
- 周辺虹彩切除術
- 原発閉塞隅角症、原発閉塞隅角緑内障に対して行われる。近年、単独白内障手術との効果の比較検討が行われている。
- 毛様体破壊術
- レーザーもしくは冷凍凝固によって房水を作る毛様体を破壊して眼圧を下げる手術。複数回の施術が必要となる場合がある。
- 前部硝子体切除術
- 悪性緑内障に対して行われる。
代替医療
緑内障に関して、エビデンスレベルの高い代替医療は報告されていない。血流改善薬や視神経保護薬による緑内障治療が期待されているが現在のところエビデンスレベルの有効性は確認されていない。そのほか星状神経性節ブロック、高圧酸素、胎盤 (プラセンタ) 抽出物、イチョウ葉抽出物 (英: Ginkgo biloba) などが緑内障の進行を抑制したという報告もあるが[要出典]現在のところ信頼に足るものではない。
根本医療
視神経の再生研究
- 傷ついた視神経の再生実験
2010年、東京都神経科学総合研究所の共同研究チームがマウス実験において視神経を再生させるメカニズムを解明し、傷付いた視神経を再生することに成功した。行方和彦と原田高幸らは、神経細胞のDock 3タンパク質に着目し、同タンパクを作る遺伝子をマウスの視神経に導入すると視神経の活発な再生を確認した。この後野生型の5倍強く働くマウスを人工的に作成し、眼球近くの視神経を傷つけたところ大幅な視神経の再生を確認し、これと野生型との有意差を確認した[28]。
- ヒトiPS細胞よりの視神経の再生実験
2015年2月、国立成育医療研究センターの研究チームがヒトのiPS細胞から視神経細胞をつくることに世界で初めて成功したと発表した。作製された視神経細胞は神経として機能することを示す電気反応などが確認されている[29]。
網膜全体の人工作成実験
2011年4月7日、理化学研究所発生・再生科学総合研究センターの笹井芳樹博士の研究チームはマウスのES細胞から網膜全体を作ることに成功したと英科学誌『ネイチャー』に発表した。ES細胞から網膜を立体的に作ったのは世界初の試みであり、研究チームは2年以内のヒトの網膜での実用化、更には臨床への応用を計画している[3]。
臨床応用
2014年9月12日、高橋政代(神戸理化学研究所網膜再生医療研究開発プロジェクト代表)は自己由来のiPS細胞から作成した網膜を患者へ移植する臨床研究を世界で初めて実施した[30][31]。これは加齢黄斑変性の治療を目的としたものであるが、これまで動物実験でのみ行われてきた人工的に作成した網膜を生体に移植する研究を実際に人体に応用した嚆矢である。
世界緑内障週間
世界緑内障週間(World Glaucoma Week; WGW)は、世界緑内障連盟と世界緑内障患者連盟により2008年から毎年3月に行われている、緑内障啓発の世界的な取り組み[32]。2021年は3月7日〜13日に行われる[32]。
脚注
関連項目
外部リンク
- 理化学研究所 発生・再生科学総合研究センター網膜再生医療研究チーム - ウェイバックマシン(2014年8月25日アーカイブ分)
- 日本緑内障学会 多治見緑内障疫学調査報告 - ウェイバックマシン(2020年8月12日アーカイブ分)
- 緑内障診療ガイドライン(第5版)
- Glaucoma - ウェイバックマシン(2012年10月12日アーカイブ分) (英語) Medpedia「緑内障」の項目。 - 日本眼科医会
- 緑内障といわれた方へ-日常生活と心構え- - 日本眼科医会
- よくわかる緑内障-診断と治療- - 日本眼科医会
- 緑内障 - MSDマニュアル
- 緑内障フレンド・ネットワーク
