Млечна киселина
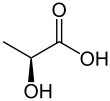
Млечната киселина е органско соединение со хемиска формула CH3CH(OH)COOH. Таа е бела, кристална супстанца, со кисел вкус и растворлива е во вода. Кога е во течна агрегатна состојба, таа е безбојна. Се добива по природен и синтетски пат. Бидејќи има хидроксилна група во непосредна близина на карбоксилната група, млечната киселина се класифицира како алфа-хидрокси киселина. Кога е во форма на својата конјугирана база, наречена лактат, таа игра значајна улога во разни биохемиски процеси.
| |||
Претпочитано име по МСЧПХ: 2-хидроксипропанска киселина | |||
| Назнаки | |||
|---|---|---|---|
| 50-21-5 79-33-4 (L) 10326-41-7 (D) | |||
| ChEBI | CHEBI:422 | ||
| ChEMBL | ChEMBL330546 | ||
| ChemSpider | 96860 | ||
IUPHAR/BPS | 2932 | ||
| 3Д-модел (Jmol) | Слика | ||
| |||
| UNII | 33X04XA5AT | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Точка на топење | |||
| Точка на вриење | |||
| Киселост (pKa) | 3.86,[1] 15.1[2] | ||
| Термохемија | |||
| Ст. енталпија на согорување ΔcH | 1361.9 kJ/mol, 325.5 kcal/mol, 15.1 kJ/g, 3.61 kcal/g | ||
| Pharmacology | |||
| ATC код | G01AD01 QP53 | ||
| Опасност | |||
| GHS-ознаки: | |||
Пиктограми |  [3] [3] | ||
Изјави за опасност | H315, H318[3] | ||
Изјави за претпазливост | P280, P305+P351+P338[3] | ||
| Слични супстанци | |||
| Други анјони | лактат | ||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Во раствор, протонот од карбоксилната група може да се јонизира, што резултира со добивање на лактатен анјон CH3CH(OH)COО-. Во споредба со оцетната киселина, нејзината pKa вредност е за една единица помала, што значи дека млечната киселина се депротонира десет пати полесно отколку оцетната киселина. Повисоката киселост е последица на меѓумолекулската водородна врска помеѓу α-хидроксилната група и карбоксилната група.
Млечната киселина е хирална супстанца, која се состои од два оптички изомери. Едниот изомер е познат како L-(+)-млечна киселина или (S)-млечна киселина, а другиот како D-(-)-млечна киселина или (R)-млечна киселина. Смесата од двата изомери со еднакви количини се нарекува DL-млечна киселина или рацемска млечна киселина.

Млечната киселина е хигроскопна. DL-млечната киселина се меша со вода и со етанол над точката на топење, која е околу 17 или 18 °C. Чистите D-млечна киселина и L-млечна киселина имаат повисоки точки на топење.
Кај животните, L-лактатот постојано се произведува од пируват со помош на ензимот лактат дехидрогеназа (LDH) во процес на ферментација, за време на нормалниот метаболизам и при вежбање. Концентрацијата не се зголемува сѐ додека стапката на продукција не ја надмине стапката на елиминација на лактатот, што е регулирано од бројни фактори, вклучувајќи ги монокарбоксилатните транспортери, концентрацијата и изоформата на LDH и оксидативниот капацитет на ткивата. Концентрацијата на лактат во крвта обично изнесува 1-2 mmol/L во мирување, но може да се зголеми над 20 mmol/L за време на интензивен физички напор,[4] па дури до 25 mmol/L после физичкиот напор.[5]
Во индустријата, ферментацијата на млечната киселина се прави со бактерии на млечно-киселинско вриење, кои ги претвораат простите јаглехидрати, како што се гликоза, сахароза или галактоза, во млечна киселина. Овие бактерии можат да се најдат и во усната празнина, а млечната киселина која ја продуцираат е одговорна за појава на кариес.[6][7][8][9]
Во медицината, лактатот е една од главните компоненти на лактатниот Рингеров и Хартманов раствор.[10] Овие интравенозни раствори содржат катјони на натриум и калиум, заедно со лактатни и хлоридни анјони растворени во дестилирана вода, во концентрации изотонични со човечката крв. Најчесто се користи за замена на течности по губење на крв поради траума, изгореници или при хируршки интервенции.
Историја
Млечната киселина за првпат била изолирана од кисело млеко, од страна на шведскиот хемичар Карл Вилхелм Шеле, во 1780 година.[11] Името на ова соединение е изведено од латинскиот збор за млеко. Во 1808 година, Јенс Јакоб Берцелиус открил дека млечната киселина (всушност, L-лактатот), исто така, се продуцира во мускулите за време на физички напор.[12][13] Структурата на млечната киселина ја открил Јоханес Вислиценус во 1873 година.
Во 1856 година, Луј Пастер го открил Lactobacillus и неговата улога во создавањето на млечна киселина. Млечната киселина почнала комерцијално да се произведува од германската аптека Берингер Ингелхајм, во 1895 година.[14]
Во 2006 година, глобалното производство на млечна киселина достигнало 275.000 метрички тони со просечен годишен прираст од 10%.
Производство
Млечната киселина се произведува индустриски со бактериска ферментација на јаглехидрати (шеќер, скроб) или со хемиска синтеза од ацеталдехид, кој се добива од јаглен или од сирова нафта.[15] Во 2009 година, најголем процент од млечната киселина (70-90%)[16] бил произведен по пат на ферментација. Производството на рацемска млечна киселина, составена од смеса на D и L стереоизомерите во однос 1:1, или од смеса со до 99,9% L-млечна киселина, е можно со микробна ферментација. Индустриско производството на D-млечна киселина со ферментација е можно, но е потешко.
Производство со ферментација
Ферментираните млечни производи се добиваат индустриски со ферментација на млеко или сурутка со помош на бактериските видови од родот Lactobacillius: Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus delbrueckii subsp. bulgaricus (Lactobacillus bulgaricus) и Lactobacillus helveticus, а исто така и од Streptococcus salivarius subsp. thermophilus (Streptococcus thermophilus) и Lactococcus lactis.
Како почетен материјал во индустриското производство на млечна киселина, која потоа се користи за хемиски синтези, може да послужи речиси секој извор на јаглехидрати кој содржи C5/C6 шеќери. Најчесто се употребуваат чиста сахароза, гликоза од скроб и сиров сок од шеќерна репка.[17] Бактериите на млечно-киселинско вриење се делат на две групи: хомоферментативни бактерии, како Lactobacillus casei и Lactococcus lactis, кои произведуваат два мола на лактат од еден мол на гликоза, и хетероферментативни видови кои произведуваат еден мол на лактат од еден мол на гликоза, како и јаглерод диоксид и оцетна киселина/етанол.[18]
Хемиско производство
Рацемичната млечна киселина се произведува во индустријата со додавање на водороден цијанид на ацеталдехид и со последователна хидролиза на формираниот лактонитрил. Синтезата и на рацемична и на енантиомерно-чиста млечна киселина е, исто така, можна и со други почетни материјали (винил ацетат, глицерол, итн.) со употреба на каталитички постапки.[19]
Поврзано
- Хидроксибутерна киселина
- Киселини во вино
- Биоразградлива пластика
- Забен кариес
- Тиолактична киселина
- Лактат дехидрогеназа
Наводи
Надворешни врски
- Пластика добиена од пченка Архивирано на 21 ноември 2013 г. (англиски)
- Млечна киселина: информации и ресурси (англиски)
- Млечната киселина не е непријател на мускулите, туку гориво (англиски)