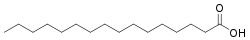
Àcid carboxílic
Els àcids carboxílics constitueixen un grup de composts que es caracteritza pel fet que posseeixen un grup funcional anomenat grup carboxil o grup carboxi (–COOH); es produeix quan coincideixen sobre el mateix carboni un grup hidroxil (-OH) i carbonil (C=O). Es pot representar com COOH o CO₂H.

Característiques i propietats
Els derivats dels àcids carboxílics tenen com a fórmula general R-COOH. Té propietats àcides; els dos àtoms d'oxigen són electronegatius i tendeixen a atraure als electrons de l'àtom d'hidrogen del grup hidroxil amb el que es debilita l'enllaç i és més fàcil que se cedeixi el corresponent protó, H+, quedant el neutró de l'àcid, R-COO-. A més, en aquest anió, la càrrega negativa es distribueix (es deslocalitza) simètricament entre els dos àtoms d'oxigen, de forma que els enllaços carboni-oxigen adquireixen un caràcter d'enllaç parcialment doble.
Generalment els àcids carboxílics són àcids dèbils, amb només un 1% de les seves molècules dissociades per a donar els corresponents ions, a temperatura ambient i en dissolució aquosa. Però si són més àcids que altres, en els que no es produeix aquesta deslocalitzacio electrònica, com per exemple els alcohols. L'ió resultant, R-COO-, s'anomena amb el sufix "-at". Per exemple, l'anió procedent de l'àcid acètic s'anomena ió acetat. Al grup COO- se l'anomena carboxilat. 
Propietats físiques
Els àcids de massa molar baixa (fins a deu àtoms de carboni) són líquids incolors, d'olor molt desagradable. L'olor del vinagre es deu a l'àcid acètic; el de la mantega rància a l'àcid butíric. L'àcid caproic es troba en el cabell i secrecions del bestiar caprí. Els àcids C5 a C10 posseeixen olors a “cabra”. La resta sòlids cerosos e inodors a temperatura ambient. Els seus punts de fusió i ebullició creixen en augmentar la massa molar.
Els àcids inferiors són solubles en aigua; la seva solubilitat decreix a partir de l'àcid butíric amb l'augment del caràcter hidrocarbonat de la molècula. Tots els àcids són solubles en solvents orgànics.
Síntesi
Rutes industrials
Les rutes industrials als àcids carboxílics difereixen generalment de les utilitzades a petita escala perquè requereixen equipament especialitzat.
- Oxidació d'aldehids amb aire, utilitzant catalitzadors de cobalt i magnesi. Els aldehids necessaris són obtinguts fàcilment a partir d'alquens per hidroformilació.
- Oxidació d'hidrocarburs utilitzant aire. Per als alcans més simples, el mètode no és selectiu. Els compostos al·lílics i benzílics pateixen oxidacions més selectives. Els grups alquil en un anell benzenic s'oxiden a l'àcid carboxílic, sense importar la longitud de la cadena. La formació d'àcid benzoic a partir del tolué, d'àcid tereftàtalic a partir del p-xilé, i d'àcid ftàlic a partir de o-xilè, són algunes conversions il·lustratives a gran escala. L'àcid acrílic és generat a partir del propè.[1]
- Deshidrogenació d'alcohols, catalitzada per bases.
- La carbonilació és el mètode més versàtil quan va acompanyat a l'addició d'aigua. Aquest mètode és efectiu per alquens que generen carbocations secundaris i terciaris, per exemple, d'isobutilè a àcid pivàlic. En la reacció de Koch, l'addició d'aigua i monòxid de carboni a alquens està catalitzat per àcids forts. L'àcid acètic i l'àcid fòrmic són produïts per la carbonilació del metanol, portada a terme amb iode i alcòxid, els quals actuen com a promotors, i freqüentment amb altes pressions de monòxid de carboni, generalment involucrant diversos passos hidrolitics addicionals, en els procés Monsanto i procés Cativa. Les hidrocarboxilacions involucren l'addició simultània d'aigua y CO. Aquestes reaccions són anomenades algunes vegades com “Química de Reppe”:
- HCCH + CO + H₂O → CH₂=CHCO₂H
- Alguns àcids carboxílics de cadena llarga són obtinguts per la hidròlisi dels triglicèrids obtinguts d'olis i grasses de plantes i animals. Aquests mètodes estan relacionats a l'elaboració de sabó.
Mètodes de laboratori
Els mètodes de preparació per a reaccions a petita escala amb fins d'investigació, instrucció, o producció de petites quantitats de químics, solen utilitzar reactius cars.
- L'oxidació d'alcohols primaris amb agents oxidants forts com el dicromat de potassi, el reactiu de Jones, el permanganat de potassi o el clorit de sodi. El mètode és adequat a les condicions de laboratori, comparat amb l'ús industrial de l'aire, però aquest últim és més ecològic, ja que condueix a menys subproductos inorgànics, com òxids de crom o magnesi.
- Ruptura oxidativa d'olefines, per ozonòlisi, permanganat de potassi o dicromat de potassi.
- Els àcids carboxílics també poden obtenir-se per la hidròlisi dels nitrils, èsters, o amides, generalment amb catàlisi àcida o bàsica.
- Carbonilació d'un reactiu d'organoliti o Grignard:
- RLi + CO₂ RCO₂Li
- RCO₂Li + HCl RCO₂H + LiCl
- Halogenació de metilcetones, seguida per hidròlisi en la reacció de l'haloform.
- La reacció de Kolbe-Schmitt, que proveeix una ruta de síntesi a l'àcid salicílic, precursor de l'aspirina.
Reaccions menys comuns
Moltes reaccions condueixen a àcids carboxílics, però són utilitzades només en casos molt específics, o principalment són d'interès acadèmic:
- Desproporció d'un aldehid en la reacció de Cannizzaro.
- Recomposició de dicetones, en la recomposició de l'àcid benzílic, involucrant la generació d'àcids benzoics en la reacció de von Richter, a partir de nitrobenzens, i en la reacció de Kolbe-Schmitt, a partir de fenols.
Reaccions
Els àcids carboxílics reaccionen amb bases per a formar sals. En aquestes sals l'hidrogen del grup OH es substitueix amb l'ió d'un metall, per exemple Na+. D'aquesta manera, l'àcid acètic reacciona amb hidrogencarbonat de sodi per a donar acetat de sodi, diòxid de carboni i aigua.
- CH₃COOH + NaHCO₃ → CH₃COONa + CO₂ + H₂O
Els grups carboxils reaccionen amb els grups amino per a formar amides. En el cas d'aminoàcids que reaccionen amb altres aminoàcids per donar proteïnes, a l'enllaç de tipus amida que es forma i s'anomena enllaç peptídic. Igualment, els àcids carboxílics poden reaccionar amb alcohols per a formar èsters, o bé amb halogenurs per a formar halogenurs d'àcid, o entre si per a formar anhídrids. Els èsters, anhídrids, halogenurs d'àcid i amides s'anomenen derivats d'àcid.
Nomenclatura
Els noms dels àcids carboxílics es designen segons la font natural de la qual inicialment es van aïllar. Es van classificar així:
| Estructura | Nom IUPAC | Nom comú | Font natural |
|---|---|---|---|
| HCOOH | Àcid metanoic | Àcid fòrmic | Destil·lació destructiva de formigues (formica en llatí) |
| CH₃COOH | Àcid etanoic | Àcid acètic | Fermentació del vi |
| CH₃CH₂COOH | Àcid propanoic | Àcid propiònic | Fermentació de làctics (pion en grec) |
| CH₃CH₂CH₂COOH | Àcid butanoic | Àcid butíric | Mantega (butyrum, en llatí) |
| CH₃(CH₂)₃COOH | Àcid pentanoic | Àcid valèric | Arrel de la Valeriana officinalis |
| CH₃(CH₂)₄COOH | Àcid hexanoic | Àcid caproic | Greix de cabra |
En el sistema IUPAC els noms dels àcids carboxílics es formen afegir “oic”, i anteposant la paraula àcid.
L'esquelet dels àcids alcanoics s'enumera assignant el Nº 1 al carboni carboxílic i continuant per la cadena més llarga que inclogui el grup COOH.
Exemples d'àcids carboxílics
- HCOOH àcid fòrmic (es troba en insectes, es refereix a les formigues)
- CH₃COOH àcid acètic o etanoic (es troba al vinagre)
- HOOC-COOH àcid etanodioic, també anomenat àcid oxàlic,
- CH₃CH₂COOH àcid propanoic
- C₆H₅COOH àcid benzoic (el benzoat de sodi, la sal de sodi de l'àcid benzoic s'utilitza com a conservant)
- Àcid làctic
- Tots els aminoàcids contenen un grup carboxil i un grup amino. Quan reacciona el grup carboxil d'un aminoàcid amb el grup amino d'un altre es forma un enllaç amida anomenat enllaç peptídic. Les proteïnes són polímers d'aminoàcids i tenen en un extrem un grup carboxil terminal.
- Tots els àcids grassos són àcids carboxílics. Per exemple, l'àcid palmític, àcid pelargònic, esteàric, oleic, linoleic, etcètera. Aquests àcids amb la glicerina formen èsters anomenats triglicèrids.
- Les sals d'àcids carboxílics de cadena llarga s'utilitzen com a tensoactius. Per exemple, l'estearat de sodi (octadecanoat de sodi), de fórmula CH₃(CH₂)16COO-Na+
- Cianoacrilat
Referències
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Àcid carboxílic |