Карбоксилна киселина
Карбоксилните киселини са органични киселини, характеризиращи се с присъствието на карбоксилна група, чиято формула е -C(=O)-OH, обикновено изписвана като -COOH. Общо наименование на солите на карбоксилните киселини е „карбоксилати“.
| Карбоксилна киселина | |
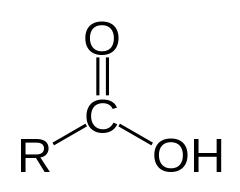 Структура на карбоксилната киселина | |
| Идентификатори | |
|---|---|
| MeSH | D002264 |
| ChEBI | 33575 |
| SMILES | OC([*])=O |
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |
| Карбоксилна киселина в Общомедия | |


Най-простата поредица от карбоксилни киселини са алкановите киселини, R-COOH, където R е водород или алкилна група. Има и съединения с две или повече карбоксилни групи в молекулата.
Физични свойства
Карбоксилните киселини са широко разпространени в природата и обикновено са слаби киселини, което означава, че те се дисоциират само частично до H+ катиони и RCOO− аниони във воден разтвор. Например само 0,02% от всички молекули оцетна киселина се дисоциират при стайна температура в разтвор.
Двата електроотрицателни кислородни атома са склонни да притеглят електрона на водородния атом, така че останалият протон H+ може лесно да се откъсне. Това обяснение използва т.нар. индуктивни ефекти. Киселинността на една карбоксилна киселина може да се обясни също чрез резонансни ефекти. Резултатът от дисоциацията на една карбоксилна киселина е резонансно стабилизиран продукт, в който отрицателният заряд е разделен (делокализиран) между двата кислородни атома. Всяка от връзките въглерод-кислород има т.нар. частична двойновръзкова характеристика.
Присъствието на електроотрицателни групи (като -OH или -Cl) до карбоксилната група увеличава киселинността чрез индуктивни ефекти. Например трихлороцетната киселина (три -Cl групи) е по-силна от млечната киселина (една -OH група), която е по-силна от оцетната киселина (без електроотрицателна част).
Карбоксилните киселини най-лесно се идентифицират като такива чрез инфрачервена спектрометрия. Характерното O-H разтягане на карбоксилната група се визуализира като широк пик в областта 2500 до 3000 cm-1.
В 1H NMR спектрометрията въглеродът на хидроксилната група се визуализира в 10 – 13 ppm областта.
Синтез
Карбоксилни киселини могат да се получат в лаборатория по различни методи, някои от които са:
- Пълно окисляване на първични алкохоли и алдехиди. Това може да се направи с реактив на Джоунс или реактив на Толенс.
- Алкенно окислително разцепване чрез калиев перманганат или хромова киселина.
- Алкилбензеново окисление на калиев перманганат до бензоеви киселини.
- Киселинна или основна хидролиза на нитрили.
- Хидролиза на амиди или естери (осапунване).
- Карбонилация (реакция с въглероден диоксид) на реактиви на Гриняр.
- Диспропорционация на алдехид в реакцията на Канидзаро.
- Пренареждане на дикетони в пренареждане с бензилова киселина.
- Халогенация, последвана от хидролиза на метилни кетони в халоформна реакция.
- По-рядко използвани реакции, включващи генериране на бензенови киселини са реакцията на фон Рихтер от нитробензени и реакцията на Колбе-Шмит от феноли.
Реакции
- Карбоксилните киселини реагират с основи и образуват карбоксилатни соли, в които водородът от хидроксилната група (-OH) е заменен от метален йон. Така етановата киселина (IUPAC името на оцетната киселина) реагира с натриев бикарбонат (сода за хляб) и образува натриев етаноат (натриев ацетат), въглероден диоксид и вода:
- CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
- Карбоксилните групи реагират и с аминни групи и образуват пептидни връзки и с алкохоли, като образуват естери в естерификация на Фишер или реакция на Мицунобу.
- Карбоксилните киселини реагират с тионилхлорид (SOCl2) и образуват ацил хлориди. Те са изключително реактивни и са полезни за синтез на други органични вещества.
- Карбоксилните киселини могат да се редуцират с LiAlH4 и образуват първични алкохоли, въпреки че тази реакция може да бъде бавна, тъй като първа стъпка често е образуването на литиев карбоксилат. Друг редуциращ агент при тази реакция е боранът.
- Синтезът на Арнд-Айстерт вмъква една α-метиленова група в карбоксилна киселина.
- Пренареждането на Къртис преобразува карбоксилни киселини в изоцианати.
- Карбоксилните киселини се декарбоксилират в реакцията на Хунсдикери се α-бромират в халогениране на Хел-Фолхард-Зелински.
- Реакцията на Дейкин-Уест преобразува една аминокиселина в съответния ѝ аминокетон.
Добавянето на карбоксилна група към дадено съединение се нарича карбоксилация, отстраняването – декарбоксилация. Ензимите, които катализират тези реакции са карбоксилази (EC 6.4.1) и декарбоксилази (EC 4.1.1).
Номенклатура и примери
Карбоксилатният анион R-COO– обикновено се назовава с наставка „-ат“, така че оцетната киселина, например, дава ацетатен йон.
Някои представители на карбоксилните киселини са:
- аминокиселини – градивните съставки на белтъците.
- мастни киселини – където R е алкан в наситените киселини и алкен в ненаситените.
- Мравчена киселина (метанова киселина) – HCOOH, намираща се в жилата на насекомите.
- Оцетна киселина (етанова киселина) – CH3COOH, основна съставка на оцета.
- Акрилова киселина (2-пропенова киселина) – CH2=CHCOOH, използвана в синтеза на полимери.
- Пропионова киселина (пропанова киселина) – CH3CH2COOH.
- Бутирова киселина (бутанова киселина) – намира се в гранясало масло.
- Лаврова киселина (додеканова киселина) – намира се в кокосовото масло.
- Докосахексанова киселина – хранителна добавка.
- Ейкосапентанова киселина – хранителна добавка.
- Кетокиселини – киселини, важни за биохимията, които съдържат кетонна група.
- Пировинена киселина
- Ацетооцетна киселина
- Млечна киселина (2-хидроксипропанова киселина) – намира се в киселото и прокисналото мляко.
- Ароматни карбоксилни киселини
- Бензоена киселина – C6H5COOH. Натриевият бензоат, натриевата сол на бензоената киселина, се използва като консервант за храни.
- Салицилова киселина – използва се в много козметични продукти.
- Дикарбоксилни киселини – съдържат две карбоксилни групи.
- Оксалова киселина – има я в много храни.
- Малонова киселина.
- Ябълчна киселина – има я в ябълките.
- Янтарна киселина – компонент, участващ в цикъла на Кребс.
- Глутарова киселина.
- Адипинова киселина – мономерът, използван за производство на наилон.
- Трикарбоксилни киселини – съдържат три карбоксилни групи.
- Лимонена киселина – има я в цитрусовите плодове.