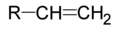Acid carboxilic
Acizii carboxilici sunt acizi organici care conțin în molecula lor o grupă funcțională carboxil , -C(=O)OH, formată dintr-o grupă carbonilică, -C(=O)-, și o grupă hidroxil, -OH, legată direct de atomul de carbon carbonilic.[1][2] Se poate spune astfel că formula generală a unui acid carboxilic este R-COOH, R fiind un rest organic. Acizii carboxilici alcătuiesc o clasă variată și numeroasă de compuși organici, aceștia fiind larg răspândiți în natură, precum sunt acidul formic, acidul acetic, acizii grași, aminoacizii (glicină, alanină, etc), acizii dicarboxilici, etc.


Grupa carboxil conferă moleculelor proprietăți acide slabe, astfel că aceasta poate fi deprotonată cu obținerea anionului carboxilat, putând forma săruri sau carboxilați. Reacția chimică prin care se grefează o grupă carboxil în structura unei molecule se numește reacție de carboxilare, iar enzimele care catalizează aceste reacții se numesc carboxilaze (CE 6.4.1) și, respectiv, decarboxilaze (CE 4.1.1).
Lungimea legăturii duble C=O din grupa carboxil poate fi calculată prin spectroscopie.
Nomenclatură
Denumirea IUPAC a acizilor carboxilici se face adăugând termenul acid în fața rădăcinii și prin adăugarea sufixului -oic.[3] Un număr mare de acizi carboxilici prezintă denumiri comune, uzuale, triviale, acestea fiind asemănătoare ca structură cu denumirea sistematică (prezintă sufixul -ic). De exemplu, cel mai simplu acid carboxilic, H-COOH, este denumit comun acid formic și sistematic acid metanoic. În cazul unor compuși cu structură mai complexă care conțin grupe carboxilice, acestea sunt considerate ca fiind prioritare, iar catena ce conține grupa carboxil este cea principală. De exemplu, denumirea corectă pentru CH3-CH(Cl)-COOH este acid 2-cloropropanoic. Singurul caz în care grupa carboxil nu este prioritară este în cazul unui compus ionic, de exemplu corect este: clorură de carboxi-piridiniu.
Anionul carboxilat (R–COO− sau RCO2−) derivat de la un acid carboxilic este denumit de obicei cu sufixul -at, aceasta fiind nomenclatura uzuală pentru perechea acid-bază conjugată. De exemplu, baza conjugată a acidului acetic este ionul acetat.
Denumirile unor acizi comuni
În următoarele tabele se regăsesc denumirile unor acizi carboxilici comuni, și se ține cont și de clasificarea acestora în funcție de anumite criterii (vezi și secțiunea Clasificare).[4]
| Număr de atomi de carbon | Denumire uzuală | Denumire IUPAC | Formulă chimică | Note (surse uzuale) |
|---|---|---|---|---|
| 1 | Acid carbonic | Acid carbonic | OHCOOH | sisteme tampon sanguine și tisulare |
| 1 | Acid formic | Acid metanoic | HCOOH | înțepătura furnicilor |
| 2 | Acid acetic | Acid etanoic | CH3COOH | oțet |
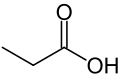
| 3 | Acid propionic | Acid propanoic | CH3CH2COOH | conservanți, miros corporal, lapte, unt, brânzeturi |
| 4 | Acid butiric | Acid butanoic | CH3(CH2)2COOH | unt |
| 5 | Acid valerianic | Acid pentanoic | CH3(CH2)3COOH | valeriană |
| 6 | Acid capronic | Acid hexanoic | CH3(CH2)4COOH | grăsime de capră |
| 7 | Acid enantic | Acid heptanoic | CH3(CH2)5COOH | |
| 8 | Acid caprilic | Acid octanoic | CH3(CH2)6COOH | nuci de cocos |
| 9 | Acid pelargonic | Acid nonanoic | CH3(CH2)7COOH | specii de Pelargonium |
| 10 | Acid caprinic | Acid decanoic | CH3(CH2)8COOH | ulei de cocos |
| 11 | Acid undecilic | Acid undecanoic | CH3(CH2)9COOH | |
| 12 | Acid lauric | Acid dodecanoic | CH3(CH2)10COOH | ulei de cocos, săpunuri |
| 14 | Acid miristic | Acid tetradecanoic | CH3(CH2)12COOH | nucșoară |
| 16 | Acid palmitic | Acid hexadecanoic | CH3(CH2)14COOH | ulei de palmier |
| 17 | Acid margaric | Acid heptadecanoic | CH3(CH2)15COOH | |
| 18 | Acid stearic | Acid octadecanoic | CH3(CH2)16COOH | ciocolată, ceruri, săpunuri, uleiuri |
| 19 | Acid nonadecilic | Acid nonadecanoic | CH3(CH2)17COOH | grăsimi, uleiuri vegetale, feromoni |
| 20 | Acid arahidonic | Acid eicosanoic | CH3(CH2)18COOH | ulei de arahide |
| Tipul de acid | Reprezentanți |
|---|---|
| Acizi monocarboxilici nesaturați | acid acrilic (acid 2-propenoic) – CH2=CHCOOH, utilizat în sinteza polimerilor; acid crotonic (acid trans-2-butenoic) |
| Acizi grași | acizi cu catenă de mărime medie până la lungi, saturați și nesaturați, monocarboxilici, cu un număr par de atomi de carbon: acid docosahexaenoic și acid eicosapentaenoic (suplimente nutriționale) |
| Aminoacizi | acizi care conțin grupe amino, sunt unitățile structurale ale proteinelor: glicină, alanină, lizină, acid aspartic, etc |
| Cetoacizi | acizi care conțin grupe ceto, cu importanță biochimică majoră: acid acetoacetic și acid piruvic |
| Acizi carboxilici aromatici | acizi care conțin cel puțin un nucleu aromatic: acid benzoic, acid salicilic, acid ftalic |
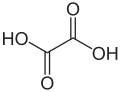
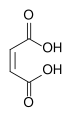
| Acizi dicarboxilici | acizi care conțin două grupe carboxil: acid oxalic și acid adipic |
| Acizi tricarboxilici | acizi care conțin trei grupe carboxil: acid citric și acid izocitric |
| Alfa-hidroxiacizi | acizi care conțin o grupă hidroxil în poziție alfa: acid gliceric, acid glicolic, acid lactic (acid 2-hidroxipropanoic) - din lapte acru, și acid tartric – din vin |
Clasificare
În primul rând, acizii carboxilici se pot clasifica după natura substituentului care se leagă de atomul de carbon din grupa carboxil în acizi alifatici și acizi aromatici. Acizii alifatici pot fi saturați (formic, acetic, propionic) sau nesaturați (acrilic, crotonic).[5][6]
- Acid formic sau acid metanoic
- Acid acetic sau acid etanoic
- Acid propionic sau acid propanoic
- Acid acrilic sau acid propenoic
- Acid crotonic sau acid trans-2-butenoic
- Acid benzoic sau acid benzencarboxilic
- Acid salicilic sau acid 2-hidroxibenzoic
De asemenea, acizii carboxilici se pot clasifica după numărul de grupe carboxilice care se regăsesc în molecula lor. Numărul grupelor se indică cu prefixe (mono, di, tri...) adăugate în fața termenului carboxilic. Astfel, acizii pot fi monocarboxilici, dicarboxilici, tricarboxilici.[6]
- Acid oxalic sau acid etandioic
- Acid malonic sau acid propandioic
- Acid adipic sau acid hexandioic
- Acid maleic sau acid cis-2-butendioic
- Acid fumaric sau acid trans-2-butendioic
Metode de obținere
Metode oxidative

Reacțiile au loc cu oxigen atomic, provenit din KMnO4 sau K2Cr2O7 în H2SO4.
Oxidarea la arene poate avea loc la catenă sau la nucleul benzenic.








Acizii se obțin prin oxidarea energică a alcoolilor (KMnO4 în H2SO4)





Metode hidrolitice
Hidroliza derivaților trihalogenați geminali

Hidroliza derivaților funcționali ai acizilor organici
- hidroliza esterilor:

- hidroliza nitrililor:

- hidroliza amidelor:

- hidroliza cu clorură acidă

- hidroliza cu anhidrida acidă

Proprietăți fizice
Acizii organici pot fi substanțe lichide sau solide, în funcție de masa lor moleculară. Cei inferiori sunt solubili în apă, iar cei superiori sunt solubili numai în solvenți organici.
Punctele lor de fierbere și de topire sunt anormal de ridicate, pentru că între moleculele de acid se formează legături de hidrogen, care sunt legături foarte puternice de atracție electrostatică.
Proprietăți chimice
- Datorită unor deplasari ale electronilor din moleculă gruparea carbonil din gruparea carboxil este blocată de un orbital molecular extins și nu poate da reacții de adiție. De exemplu nu adiționează H, deci nu se reduce.
Reacții comune cu acizii anorganici
`
Aciditatea

Tăria acizilor carboxilici variază, în sensul că tăria înseamnă capacitatea (sau ușurința) de a ceda protoni:
- odată cu creșterea numărului de atomi de carbon scade aciditatea;
- odată cu creșterea numărului de grupe carboxil crește aciditatea;
- odată cu creșterea gradului de ramificație a catenei acidului scade aciditatea;

Reacția cu metale active


Reacția cu oxizii metalici


Reacția cu bazele


Reacția cu săruri ale acizilor mai slabi ca ei



Reacții caracteristice
În urma acestor reacții rezultă, cel mai frecvent, derivați funcționali ai acizilor organici.
Reacția cu alcooli
Aceasta se mai numește și reacție de esterificare.


Reacția cu amoniac
În primul pas al acestei reacții, se adiționează la acid o moleculă de amoniac.

Produsul de reacție de mai sus este descompus termic mai departe, având acum două posibilități.




Derivați funcționali
Derivații funcționali ai acizilor rezultă prin eliminarea unei molecule de apă dintre un H ionizabil (care apare ca proton) și o grupă -OH în cadrul aceleeași molecule sau dintre molecule diferite.
Cei mai importanți derivați sunt:
- esterii -
- clorurile acide -
- amidele -
- nitrilii -
- anhidridele acide -