Ácido carboxílico
En química orgánica, un ácido carboxílico es un ácido orgánico que contiene un grupo carboxilo (C(=O)OH) unido a un grupo R. La fórmula general de un ácido carboxílico es R-COOH o R-CO2H, donde R se refiere al grupo alquilo, alquenilo, arilo u otro. Los ácidos carboxílicos se encuentran ampliamente distribuidos en la naturaleza. Ejemplos importantes incluyen los aminoácidos y los ácidos grasos. La desprotonación de un ácido carboxílico da un anión carboxilato. Los ácidos carboxílicos poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH). En el grupo funcional carboxilo coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (-C=O).

Nomenclatura y abundancia en la naturaleza
Debido a que el ácido fórmico tiene un hidrógeno unido al carboxilo, esto le da un cierto carácter de aldehído que no presentan otros ácidos carboxílicos, por lo que se considera como un ácido muy peculiar e inclusive independiente del resto de los ácidos carboxílicos. Los ácidos carboxílicos se nombran con la ayuda de la terminación –oico o –ico que se une al nombre del hidrocarburo de referencia y anteponiendo la palabra ácido:
EjemploCH3-CH2-CH3propanoCH3-CH2-COOHÁcido propanoico (propan + oico)
Los nombres triviales de los ácidos carboxílicos se designan según la fuente natural de la que inicialmente se aislaron. Se clasificaron así:
| Nombre trivial | Nombre IUPAC | Estructura | Nombre de la fuente |
|---|---|---|---|
| Ácido fórmico | Ácido metanoico | HCOOH | Del Lat. formica, hormiga. |
| Ácido acético | Ácido etanoico | CH3COOH | (del fr: acétate), acuñado en 1787 por el químico francés Louis-Bernard Guyton de Morveau a partir del latín acetum, 'vinagre'. |
| Ácido propiónico | Ácido propanoico | CH3CH2COOH | Del francés acide propionique, acuñado por el químico Jean-Baptiste Dumas, del griego πρῶτος (prôtos) ("primero") y πίων (píōn) ("grasa"), ya que fue el ácido carboxílico más pequeño que exhibió las propiedades de otros ácidos grasos, tales como su insolubilidad parcial en una disolución salina sobresaturada, y por presentar una sal potásica similar a un jabón. |
| Ácido butírico | Ácido butanoico | CH3(CH2)2COOH | Del griego βούτυρος (boúturos, "mantequilla", inglés “butter”), de donde se aisló por primera vez. |
| Ácido valérico | Ácido pentanoico | CH3(CH2)3COOH | La palabra ‘’valeriana’’ designa a cualquier planta del género Valeriana, L. 1753, cuya especie representativa y más conocida (V. officinalis) llegó a considerársela como una panacea. Del latín tardío ‘’valeriana’’ muy probablemente en referencia al nardo céltico o rústico (V. celtica, L. 1753, una especie propia de los Alpes, la palabra parece derivar de valêo, ûi, îtum con los significados ’’ser eficaz’’, ‘’tener salud’’,’’valer’’, estar sano, tener poder (en la historia de Roma, muchos gobernantes y hombres distinguidos llevaban el nombre de Valerius, tales como Valerio Valente y Cayo Valerio Maximiliano. |
| Ácido caproico | Ácido hexanoico | CH3(CH2)4COOH | Del latín capra; cabra. Es uno de los ácidos que contribuyen al aroma característico de la carne de caprino. |
| Ácido enántico | Ácido heptanoico | CH3(CH2)5COOH | Relativo a Oenanthe, un género de plantas de la familia de las apiáceas, conocidas como "felandrio" o "perejil de brujas". Proviene del lat. oenanthe, gr. οἰνάνϑη «racimo de vid salvaje». |
| Ácido caprílico | Ácido octanoico | CH3(CH2)6COOH | Del latín capra; cabra. Es uno de los ácidos que contribuyen al aroma característico de la carne de caprino. |
| Ácido pelargónico | Ácido nonanoico | CH3(CH2)7COOH | Los geranios que pertenecen al género Pelargonium son de los que se tomó el nombre para el ácido. En 1738, Johannes Burman nombró el género Pelargonium (del griego πελαργός, pelargós cigüeña) debido a la semejanza de parte de la flor con esta ave.[1][2] |
| Ácido cáprico | Ácido decanoico | CH3(CH2)8COOH | Del latín capra; cabra. Es uno de los ácidos que contribuyen al aroma característico de la carne de caprino. |
| Ácido undecílico | Ácido undecanoico | CH3(CH2)9COOH | IUPAC - numeral del esqueleto de once carbonos |
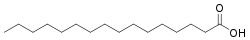
| Ácido láurico | Ácido dodecanoico | CH3(CH2)10COOH | Del Latin laurus, “laurel”. |
| - | Ácido tridecanoico | CH3(CH2)11COOH | IUPAC - numeral del esqueleto de trece carbonos |
| Ácido mirístico | Ácido tetradecanoico | CH3(CH2)12COOH | Del griego medieval μυριστικός (muristikós, “fragante”), y este a su vez del griego antiguo μύρον (múron, “ungüento", "perfume"). Latinizado como myristicus (“fragante”); el término latino Myristica fue designado por Linneo como género para la nuez moscada. |
| - | Ácido pentadecanoico | CH3(CH2)13COOH | IUPAC - numeral del esqueleto de quince carbonos |
| Ácido palmítico | Ácido hexadecanoico | CH3(CH2)14COOH | Del latín palma, y esta del protoindoeuropeo *pl̥h₂meh₂. Compárese el griego antiguo παλάμη (palámē). El ácido palmítico fue descubierto por Edmond Frémy en 1840, durante el estudio de la saponificación del aceite de palma.[3] |
| Ácido margárico | Ácido heptadecanoico | CH3(CH2)15COOH | Del francés acide margarique (“ácido margárico”), del griego μάργαρον (márgaron, “perla”). El químico francés Michel Eugène Chevreul lo nombró ácido margárico por su cristalización similar a perlas. Se pensaba que el ácido margárico era uno de los tres ácidos grasos que en combinación formaban las grasas animales, siendo los otros el ácido esteárico y el ácido oleico. No obstante, en 1853 se descubrió que este ácido margárico no era más que una combinación de ácido esteárico y del ácido palmítico, antes desconocido. En la década de los años 1860, el emperador Napoleón III de Francia ofreció una recompensa a cualquiera que pudiera elaborar satisfactoriamente un sustituto a la mantequilla, cara y difícil de conservar, para las clases sociales bajas y las fuerzas armadas: un «cuerpo graso como la mantequilla, pero de precio inferior, apta para conservarse largo tiempo sin alterarse guardando su valor nutricional».[4] El farmacéutico Hippolyte Mège-Mouriès realizó una emulsión blanca resultante de la grasa de vacuno fraccionada, de leche y de agua, bautizada «oleomargarina» (que después acortó a margarina, del griego μάργαρον, /margaron/, 'blanco de perla' y del nombre polialcohol-glicerina). |
| Ácido esteárico | Ácido octadecanoico | CH3(CH2)16COOH | Del griego στέαρ (stéar, “sebo”). Chevreul asignó este nombre ya que lo aisló de la estearina, una sustancia blanca aislado de muchos sebos y mantecas de origen tanto animal como vegetal. |
| - | Ácido nonadecanoico | CH3(CH2)17COOH | IUPAC - numeral del esqueleto de diecinueve carbonos |
| Ácido araquídico | Ácido eicosanoico | CH3(CH2)18COOH | Del Latin arachis (“legumbre”), y a su vez del griego άρακος (“arakos"; guisantes) probablemente de una palabra de origen asiático. Carlos Linneo reportó en Species Plantarum 2: 741. 1753, al cacahuate con el género Arachis.[5] |
| - | Ácido heneicosanoico | CH3(CH2)19COOH | IUPAC - numeral del esqueleto de 21 carbonos |
| Ácido behénico | Ácido docosanoico | CH3(CH2)20COOH | Del Aceite de behen, obtenido de la Moringa. La palabra "behen" es una transcripción latina medieval del árabe بَهْمَن (bahman). |
| - | Ácido tricosanoico | CH3(CH2)21COOH | IUPAC - numeral del esqueleto de 23 carbonos |
| Ácido lignocérico | Ácido tetracosanoico | CH3(CH2)22COOH | Del Latin lignum (“madera”) y del latín cera, idem. |
| Ácido pentacosílico | Ácido pentacosanoico | CH3(CH2)23COOH | IUPAC - numeral del esqueleto de 25 carbonos |
| Ácido cerótico | Ácido hexacosanoico | CH3(CH2)24COOH | Del latín cera |
| - | Ácido heptacosanoico | CH3(CH2)25COOH | IUPAC - numeral del esqueleto de 27 carbonos |
| Ácido montánico | Ácido octacosanoico | CH3(CH2)26COOH | Obtenido de la cera montana, una cera dura obtenida por extracción con solvente de ciertos tipos de lignito. |
| - | Ácido nonacosanoico | CH3(CH2)27COOH | IUPAC - numeral del esqueleto de 29 carbonos |
| Ácido melísico | Ácido triacontanoico | CH3(CH2)28COOH | Palabra griega μέλισσα (melissa; abeja), ya que se encontró en la cera de abeja. |
| - | Ácido henatriacontanoico | CH3(CH2)29COOH | IUPAC - numeral del esqueleto de 31 carbonos |
| Ácido laceroico | Ácido dotriacontanoico | CH3(CH2)30COOH | Del latín lacca, laca |
| Ácido psílico | Ácido tritriacontanoico | CH3(CH2)31COOH | Aislado de la zaragatona (Plantago psyllium) |
| Ácido gédico | Ácido tetratriacontanoico | CH3(CH2)32COOH | |
| Ácido ceroplástico | Ácido pentatriacontanoico | CH3(CH2)33COOH | Del latín cera y del Latín plasticus (“moldeable”), y a su vez del griego πλαστικός (plastikós), de πλάσσειν (plássein, “moldear”) |
| - | Ácido hexatriacontanoico | CH3(CH2)34COOH | IUPAC - numeral del esqueleto de 36 carbonos |
| Nombre común | Nombre IUPAC | Fórmula química | Fórmula estructural | Nombre de la fuente |
|---|---|---|---|---|
| Ácido oxálico | ácido etanodioico | HOOC-COOH |  | Acuñado a partir del término francés oxalique, de una planta del género Oxalis (“acedera). El nombre genérico que deriva de la palabra griega ὀξύ oxý, "afilado, ácido", refiriéndose al sabor agrio de las hojas y el tallo. |
| Ácido malónico | ácido propanodioico | HOOC-(CH2)-COOH |  | Del latín malus, manzana. A su vez del griego μᾶλον, manzana. |
| Ácido succínico | ácido butanodioico | HOOC-(CH2)2-COOH | 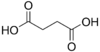 | Del Latin succinum, ámbar. |
| Ácido glutárico | ácido pentanodioico | HOOC-(CH2)3-COOH |  | Del Latin gluten (“pegamento"; inglés glue). La palabra engrudo, del latín *inglūtāre, a su vez de in- y gluten, "engrudo, pegamento". De ahí viene el término "gluten", nombre general que se le da a una proteína que compuesta de una glutelina y una prolamina, insoluble en agua, que junto con el almidón conforma la mayor parte del contenido de las semillas de los cereales, como el trigo. El sufíjo -árico es una contracción del ácido tartárico. |
| Ácido adípico | Ácido hexanodioico | HOOC-(CH2)4-COOH |  | Del latín adeps, adipis ("manteca"). |
| Ácido pimélico | ácido heptanodioico | HOOC-(CH2)5-COOH |  | Del griego πιμελος (pimelos) obeso. |
| Ácido subérico | ácido octanodioico | HOOC-(CH2)6-COOH |  | Del Latin suber, corcho. |
| Ácido azelaico | ácido nonadioico | HOOC-(CH2)7-COOH |  | De azo y el griego ἔλαιον (elaion, Olivo) |
| Ácido sebácico | ácido decadioico | HOOC-(CH2)8-COOH |  | Del latín sebum. |
| Ácido maleico | Ácido cis-butenodioico | HOOC-CH=CH-COOH | 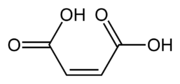 | Del latín malus, manzana. A su vez del griego μᾶλον, manzana. |
| Ácido fumárico | Ácido trans-butenodioico | HOOC-CH=CH-COOH | 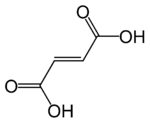 | Reportado en plantas del género descrito por Carlos Linneo y publicado en Species Plantarum, vol. 2, p. 699–701, 1753.[6] Fumaria. Nombre genérico del Latín fumus = "humo", posiblemente por el color o el olor de las raíces frescas.[7] El "humo" o el origen "fumy" de su nombre proviene del color translúcido de sus flores, dándoles la apariencia de humo o de colgar en el humo, y al color bruma ligeramente gris-azulado de su follaje, también se asemeja al humo proveniente del suelo, sobre todo después de rocío de la mañana. La planta ya fue llamado fumus terrae (humo de la tierra) a principios del siglo XIII, y hace dos mil años, Dioscórides escribió en De Materia Medica (Περὶ ὕλης ἰατρικῆς) y Plinio el Viejo en Naturalis Historia que frotarse los ojos con la savia o látex de la planta provoca lágrimas, como el humo acre (fumus) hace a los ojos.[8] |
| Ácido ftálico | ácido beceno-1,2-dicarboxílico o-ácido ftálico | C6H4(COOH)2 |  | El ácido ftálico se obtuvo por primera vez por el químico francés Auguste Laurent en 1836 mediante la oxidación de tetracloruro de naftaleno. Creyendo que la sustancia que resultó era un derivado del naftaleno, lo llamó "ácido naftalico".[9] Después de que el químico suizo Jean Charles Galissard de Marignac determinase su fórmula correcta,[10] Laurent le dio su actual nombre.[11] |
| Ácido isoftálico | ácido beceno-1,3-dicarboxílico m-ácido ftálico | C6H4(COOH)2 |  | El nombre deriva del ácido ftálico (al ser isómero posicional meta de este último). |
| Ácido tereftálico | ácido beceno-1,4-dicarboxílico p-ácido ftálico | C6H4(COOH)2 | 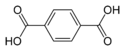 | El nombre común deriva del árbol que produce trementina, Pistacia terebinthus y ácido ftálico (al ser isómero posicional para de este último). |
| Ácido truxílico | ácido 2,4-difenilciclobutan-1,3-dicarboxílico | (C6H5)2C4H4(COOH)2 |  | El nombre deriva de un alcaloide llamado truxillina |
| Ácido truxínico | ácido 3,4-difenilciclobutan-1,2-dicarboxílico | (C6H5)2C4H4(COOH)2 |  | Es el isómero posicional del ácido truxílico, que también existe en el alcaloide truxillina. |
| Nombre trivial | Estructura química | Δx | C:D | n−x |
|---|---|---|---|---|
| Ácido acrílico | CH2=CH-COOH | - | 3:1 | n−1 |
| Ácido crotónico | CH3CH=CH-COOH | trans-Δ2 | 4:1 | n−2 |
| Ácido isocrotónico | CH3CH=CH-COOH | cis-Δ2 | 4:1 | n−2 |
| Ácido sórbico | CH3CH=CH-CH=CH-COOH | trans,trans-Δ2,Δ4 | 6:2 | n−2 |
| Ácido undecilénico | CH2=CH(CH2)8COOH | - | 11:1 | n−1 |
| Ácido palmitoleico | CH3(CH2)5CH=CH(CH2)7COOH | cis-Δ9 | 16:1 | n−7 |
| Ácido sapiénico | CH3(CH2)8CH=CH(CH2)4COOH | cis-Δ6 | 16:1 | n−10 |
| Ácido oleico | CH3(CH2)7CH=CH(CH2)7COOH | cis-Δ9 | 18:1 | n−9 |
| Ácido eláidico | CH3(CH2)7CH=CH(CH2)7COOH | trans-Δ9 | 18:1 | n−9 |
| Ácido vaccénico | CH3(CH2)5CH=CH(CH2)9COOH | trans-Δ11 | 18:1 | n−7 |
| Ácido linoleico | CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH | cis,cis-Δ9,Δ12 | 18:2 | n−6 |
| Ácido linoeláidico | CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH | trans,trans-Δ9,Δ12 | 18:2 | n−6 |
| Ácido α-Linolénico | CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH | cis,cis,cis-Δ9,Δ12,Δ15 | 18:3 | n−3 |
| Ácido ɣ-Linolénico | CH3(CH2)4CH=CHCH2CH=CHCH2CH=CH(CH2)4COOH | cis,cis,cis-Δ6,Δ9,Δ12 | 18:3 | n−6 |
| Ácido punícico | CH3(CH2)3CH=CH-CH=CH-CH=CH(CH2)7COOH | cis,trans,cis-Δ9,Δ11,Δ13 | 18:3 | n−5 |
| Ácido araquidónico | CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOHNIST | cis,cis,cis,cis-Δ5Δ8,Δ11,Δ14 | 20:4 | n−6 |
| Ácido eicosapentaenoico | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH | cis,cis,cis,cis,cis-Δ5,Δ8,Δ11,Δ14,Δ17 | 20:5 | n−3 |
| Ácido erúcico | CH3(CH2)7CH=CH(CH2)11COOH | cis-Δ13 | 22:1 | n−9 |
| Ácido docosahexaenoico | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)2COOH | cis,cis,cis,cis,cis,cis-Δ4,Δ7,Δ10,Δ13,Δ16,Δ19 | 22:6 | n−3 |
En el sistema IUPAC los nombres de los ácidos carboxílicos se forman reemplazando la terminación “o” de los alcanos por “oico”, y anteponiendo la palabra ácido.
El esqueleto de los ácidos alcanoicos se enumera asignando el n.º 1 al carbono carboxílico y continuando por la cadena más larga que incluya el grupo COOH.
- Ejemplo de ácidos carboxílico complejo:
HOCH3-CH3-CH=CH-CH(CH3-CH=CH3)-CHBr-COOH
En este compuesto aparte del grupo funcional COOH, hay una función alcohol, pero de acuerdo a su importancia y relevancia el grupo COOH es el principal; por lo tanto el grupo alcohol se lo nombra como sustituyente. Por lo tanto el nombre de este compuesto es: Ácido 3-alil-2-bromo-7-hidroxi-4-heptenoico.
La palabra carboxi también se utiliza para nombrar al grupo COOH cuando en la molécula hay otro grupo funcional que tiene prioridad sobre él.
Para mayores detalles, consulte Nomenclatura de ácidos carboxílicos
- Todos los ácidos grasos son ácidos carboxílicos. Por ejemplo, el ácido palmítico, esteárico, oleico, linoleico, etcétera. Estos ácidos con la glicerina forman ésteres llamados triglicéridos.
- Las sales de ácidos carboxílicos de cadena larga se emplean como tensoactivos.
Otros ácidos carboxílicos importantes:
- Ácido benzoico
- Ácido láctico
- Ácido tartárico
- Ácido salicílico
- Ácido cafeico
- Ácido cinámico
- Ácido cítrico
- Todos los aminoácidos contienen un grupo carboxilo y un grupo amino. Cuando reacciona el grupo carboxilo de un aminoácido con el grupo amino de otro se forma un enlace amida llamado enlace peptídico. Las proteínas son polímeros de aminoácidos y tienen en un extremo un grupo carboxilo terminal.
Características y propiedades
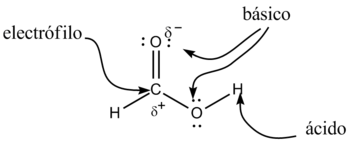
De acuerdo a su nombre IUPAC, los ácidos carboxílicos son ácidos de Brønsted-Lowry; los dos átomos de oxígeno son electronegativos y tienden a atraer a los electrones del átomo de hidrógeno del grupo hidroxilo con lo que se debilita el enlace, produciéndose en ciertas condiciones una ruptura heterolítica, cediendo el correspondiente protón o hidrón, H+, y quedando el resto de la molécula con carga -1 debido al electrón que ha perdido el átomo de hidrógeno, por lo que la molécula queda como R-COO-.

Además, en este anión, la carga negativa se distribuye (se deslocaliza) simétricamente entre los dos átomos de oxígeno, de forma que los enlaces carbono-oxígeno adquieren un carácter de enlace parcialmente doble.
Estos no solo son importantes y esenciales por su propia naturaleza, sino que además son la materia primas al momento de preparar los derivados de acilo, tales como : los cloruros de ácido, los ésteres,las amidas, y los tioésteres. Sin contar que en la mayoría de las rutas biológicas están presentes.
Generalmente los ácidos carboxílicos son ácidos débiles, con solo un 1% de sus moléculas disociadas para dar los correspondientes iones, a temperatura ambiente y en disolución acuosa.
Pero sí son más ácidos que otros, en los que no se produce esa deslocalización electrónica, como por ejemplo los alcoholes. Esto se debe a que la estabilización por resonancia o deslocalización electrónica, provoca que la base conjugada del ácido sea más estable que la base conjugada del alcohol y por lo tanto, la concentración de protones provenientes de la disociación del ácido carboxílico sea mayor a la concentración de aquellos protones provenientes del alcohol; hecho que se verifica experimentalmente por sus valores relativos menores de pKa. El ion resultante, R-COO-, se nombra con el sufijo "-ato".

Por ejemplo, el anión procedente del ácido acético se llama ion acetato. Al grupo RCOO- se le denomina carboxilato.

A continuación se analizará el comportamiento ácido-base de diversos ácidos carboxílicos[12]
| Ácido | pKA | Observaciones |
|---|---|---|
| Ácido carbónico | pKA1 = 6.35 pKA2 = 10.33 | Ácido diprótico inestable débil ya que su constante de ionización es muy pequeña, Ka : 0,000 000 45.[13] El ácido carbónico puede atacar a muchos de los minerales que comúnmente forman las rocas calizas o margosas, descomponiéndolos por ejemplo en bicarbonato de calcio.[14] Es el producto de la reacción de agua y óxido de carbono (IV) y existe en equilibrio con este último, por ejemplo, en el agua gasificada o la sangre. No es posible obtener ácido carbónico puro ya que la presencia de una sola molécula de agua catalizaría su descomposición inmediata en óxido de carbono (IV) y agua. Sin embargo, se calcula que en ausencia absoluta de agua sería estable. En disolución, el ácido carbónico puede perder uno o dos protones. Retirando el primer protón forma el anión bicarbonato; retirando el segundo protón forma el anión carbonato.
Los aniones carbonato y bicarbonato son bases más fuertes que los aniones formato y carboxilato. |
| Ácido fórmico | pKA = 3.75 | El pKa del ácido fórmico es más bajo que para cualquier ácido carboxílico convencional. Por lo tanto se infiere que el ácido fórmico es un ácido orgánico relativamente más fuerte que su equivalente inorgánico, el ácido carbónico. Esto se debe a que el hidrógeno no contribuye significativamente al efecto inductivo positivo como otros ácidos, mientras que cuando el ácido carbónico se desprotona, entra en resonancia e incrementa la simetría del anión. |
| Ácido trifluoroacético | pKA = 0.23 | Único caso de un ácido carboxílico con el carboxilo enlazado directamente a un trifluorometilo. Se trata de un ácido carboxílico fuerte debido a la influencia del intenso efecto inductivo negativo que proporcionan los tres átomos de flúor. El ácido trifluoroacético es casi 100.000 veces más ácido que el ácido acético. El ácido tricloroacético tiene un pKA = 0.66, el cual sigue siendo significativamente alto para un ácido carboxílico. |
| Ácido acético | pKA = 4.76 | El ácido acético es el único ácido carboxílico en donde el carboxilo va unido a un carbono primario. Esto resta bastante el efecto inductivo positivo. Podría considerarse este pKa como referencia para el resto de los ácidos carboxílicos. |
| Serie homóloga de ácidos grasos monocarboxílicos lineales saturados C3 - C16 | pKAC3 = 4.88 pKAC16 = 4.75 | A medida que incrementa la longitud de la cadena, la solubilidad en agua disminuye significativamente y se observa el comportamiento típico de saponificación. Los valores promedio de pKA para un ácido graso monocarboxílico lineal saturado fluctúan entre 4.7 y 4.9. |
| Ácido oxálico | pKA1 = 1.25 pKA2 = 4.14 | El ácido oxálico es el único caso en el que R para un ácido carboxílico es igual a un carboxilo R = -COOH. La consecuencia de este enlace entre ambos carboxilos es la concentración de la densidad electrónica de manera simétrica hacia ambos carbonos. El efecto inductivo negativo que ejercen ambos carboxilos es fuerte, lo suficiente para permitir la pérdida eficiente de un protón ácido. El primer pKA es mucho más bajo que para cualquier ácido carboxílico convencional, por lo que es un ácido más fuerte que el ácido fórmico, el ácido acético y los ácidos carboxílicos convencionales. |
| Ácido malónico | pKA1 = 2.83 pKA2 = 5.69 | El ácido malónico es el más sencillo de los ácidos alquilendicarboxílicos. Estos sistemas 1,3-dicarbonílicos se caracterizan porque sus ésteres son ácidos débiles en el carbono 2 (pKA = 14). El efecto inductivo de ambos carboxilos a un carbono de distancia queda evidenciado en un valor de pKA1 menor que el de un ácido carboxílico convencional, mientras que su pKA2 es mayor que el de un ácido carboxílico convencional debido al efecto significativo de repulsión electrostática y la rotación libre de ambos carboxilos. |
| Serie homóloga de ácidos grasos dicarboxílicos lineales saturados C3 - C16 | pKA1C4 = 4.2 pKA1C10 = 4.55
| A medida que incrementa la longitud de la cadena, la solubilidad en agua disminuye significativamente y se observa el comportamiento típico de saponificación. Sin embargo, los ácidos dicarboxílicos presentan ambos extremos cargados eléctricamente y esto los hace termodinámicamente más solvatables que sus análogos monocarboxílicos. El segundo pKA es ligeramente más alto debido a que cuando se sustrae el primer protón, la molécula presenta una carga formal negativa que incrementa la repulsión electrostática con la base. Los valores promedio de pKA1 para un ácido graso lineal saturado dicarboxílico son ligeramente menores que un monocarboxílico insaturado, los cuales fluctúan entre 4.2 y 4.55 entre C4 y C10. |
| Ácido piválico | pKA = 5.03 | Es el caso más sencillo de un ácido carboxílico unido a un carbono cuaternario. El efecto inductivo positivo y el impedimento estérico reducen la acidez con respecto al ácido isovalérico (pKA = 4.77) y valérico (pKA = 4.82) |
| Ácido acrílico | pKA = 4.25 | Primer ácido de la serie homóloga de los ácidos monocarboxílicos α,β-insaturados. Es ligeramente más ácido que el ácido propiónico. |
| Ácido propargílico | pKA = 1.89 | Primer ácido de la serie homóloga de los ácidos α,β-acetilencarboxílicos. Es significativamente más ácido que el ácido propiónico. La densidad electrónica con geometría cilíndrica del sistema acetilénico sustrae densidad electrónica en la que se forma un mesómero alénico de geometría lineal que permite la sustracción eficiente del protón ácido. |
Ácidos butenodioicos:
| pKA1cis = 1.90 pKA1trans = 3.03
| Ambos casos son el único ejemplo de un ácido dicarboxílico α,β-insaturado en donde ambos carboxilos comparten la insaturación. Ambos son más ácidos que un ácido carboxílico convencional debido a que la distancia entre ambos carboxilos y la insaturación disminuye significativamente la densidad electrónica en ambos carbonos carboxílicos, pero no tan drásticamente como en el ácido oxálico.El ácido cis es más ácido debido a que ambos carboxilos interactúan entre sí. Cuando se desprotona el primero, el anión carboxilato cis quelata fuertemente al otro protón ácido, por eso es menos ácido incluso que un ácido carboxílico convencional. En el caso del ácido trans, los protones ácidos están opuestos. |
| Ácido acetilendicarboxílico | pKA1 = 1.73 pKA2 = 4.40 | Es el único caso de un ácido dicarboxilacetilénico. Es significativamente más ácido que el ácido succínico y los ácidos butenodioicos. La densidad electrónica con geometría cilíndrica del sistema acetilénico sustrae densidad electrónica en la que se forma un mesómero alénico de geometría lineal que permite la sustracción eficiente del protón ácido. El otro carboxilo ejerce un efecto tanto inductivo como mesomérico negativos. |
| Ácido benzoico | pKA = 4.2 | Caso más sencillo y significativo de un ácido bencenocarboxílico. La acidez es ligeramente menor a la de un ácido carboxílico saturado. Los ácidos carboxílicos desactivan a los anillos aromáticos y orientan a meta. |
| Ácido salicílico | pKACOOH = 2.97 | El hidroxilo aporta un par electrónico que estabiliza por resonancia al anión carboxilato formado y por puente de hidrógeno y dipolo permanente, los cuales interactúan fuertemente y quelatan al hidrógeno fenólico. |
| Ácido p-hidroxibenzoico | pKACOOH = 4.54 | Aunque el hidroxilo aporta el par electrónico, la dispersión de la carga es más eficiente y por lo tanto no influye significativamente en la acidez del carboxilo. |
| Ácido picolínico (Ácido 2-piridinocarboxílico) | pKACOOH = 1.07[15] | En la resonancia de la piridina, el nitrógeno presenta un efecto mesomérico negativo y eso explica la baja de densidad electrónica en el carboxilo. |
| Ácido nicotínico (Ácido 3-piridinocarboxílico) | pKACOOH = 2.0 | En la resonancia de la piridina, el nitrógeno presenta un efecto inductivo negativo y eso explica la baja de densidad electrónica en el carboxilo. |
| Ácido isonicotínico (Ácido 4-piridinocarboxílico) | pKACOOH = 4.96 | En la resonancia de la piridina, el carboxilo se encuentra en la posición más opuesta posible y en este caso, la dispersión de la carga es más eficiente y por lo tanto no influye significativamente en la acidez del carboxilo. |
Obtención de fuentes naturales
El ácido fórmico fue aislado en 1671 por primera vez por el naturalista inglés John Ray destilándolo a partir de un lote de hormigas rojas (Formica rufa) machacadas y maceradas.[16][17][18][19]
El ácido acético es producido por biosíntesis bacteriana, a partir de la fermentación acética por Acetobacter. El microorganismo transforma el alcohol etílico en ácido acético, la sustancia característica del vinagre.[20] La fermentación acética del vino proporciona el vinagre debido a un exceso de oxígeno y es uno de los fallos del vino, un proceso que degrada sus cualidades. Hoy en día, la ruta biológica proporciona cerca del 10% de la producción mundial, pero sigue siendo importante en la producción del vinagre, dado que las leyes mundiales de pureza de alimentos estipulan que el vinagre para uso en alimentos debe ser de origen biológico. Cerca del 75% del ácido acético hecho en la industria química es preparada por carbonilación del metanol, explicada más adelante. Los métodos alternativos (como isomerización de formiato de etilo, conversión de gas de síntesis, oxidación de etileno y etanol) aportan el resto.[21][22]
El ácido propiónico se produce biológicamente del desdoblamiento metabólico de ácidos grasos con carbonos impares, y de algunos aminoácidos. Las bacterias del género Propionibacterium lo catabolizan como producto final de su metabolismo anaerobio durante el ciclo del Wood-Werkman. Estas bacterias se encuentran comúnmente en los estómagos de rumiantes, y su actividad es parcialmente responsable del olor del queso suizo y del sudor.
Todos los ácidos grasos se pueden extraer en mayor o menor medida de fuentes lipídicas de origen animal o vegetal, generalmente por saponificación de grasas, acidificación y separación primero por destilación o por cromatografía. El ácido cítrico fue el primer ácido aislado en 1784 por el químico sueco Carl Wilhelm Scheele, quien lo precipitó con óxido de calcio y lo recristalizó a partir del jugo del limón. La producción industrial del ácido cítrico comenzó en 1860, basada en la industria italiana de los cítricos. En 1893, C. Wehmer descubrió que cultivos de penicillium podían producir ácido cítrico a partir de la sacarosa. Sin embargo, la producción microbiana del ácido cítrico no llegó a ser industrialmente importante hasta la Primera Guerra Mundial que interrumpió las exportaciones italianas de limones. En 1917, los químicos americanos James Currie y Claudio Colán descubrieron que ciertos cultivos de Aspergillus niger podían ser productores eficientes de ácido cítrico, y dos años más tarde Pfizer comenzó la producción a escala industrial usando esta técnica.
Métodos de síntesis
De acuerdo a las estrategias del análisis retrosintético, se considerarán los métodos conforme a:
- Interconversiones de grupo funcional (FGI) simples
- Métodos de conexión C-C
- Métodos de desconexión C-C
De acuerdo a la escala a la que realiza la síntesis, se pueden clasificar las síntesis en industriales y de laboratorio.
- Las síntesis industriales de los ácidos carboxílicos difieren generalmente de las usadas a pequeña escala (en el laboratorio) porque requieren equipamiento especializado.
- Los métodos de preparación a escala en laboratorio con fines de investigación, instrucción, o producción de pequeñas cantidades de productos químicos suelen utilizar reactivos más caros.
Interconversiones de grupo funcional
- La primera síntesis artificial del ácido fórmico reportada en bibliografía es la desarrollada por el químico francés Théofile-Jules Pelouze en 1831 a partir de la reacción del ácido cianhídrico con ácido clorhídrico y ácido sulfúrico concentrado.[23][24] Sin embargo los métodos más actuales de síntesis se derivan de los trabajos que Pierre Eugene Marcellin Berthelot, otro químico francés, realizó entre 1855 y 1856, según los cuales:[25][26][27]
NaOH + CO → HCOONa
El formiato sódico (HCOONa) posteriormente se hace reaccionar con un ácido para formar el ácido fórmico y la sal sódica del ácido.
- La hidrogenación catalítica del anhídrido carbónico a ácido fórmico se ha desarrollado industrialmente en fase homogénea.[28][29]
- CO2 + H2 → H2CO2
- Oxidación de hidrocarburos usando aire. Para los alcanos más simples, el método no es selectivo. Los compuestos alílicos y bencílicos sufren oxidaciones más selectivas. El ácido acrílico se genera a partir del propeno. La formación de ácido benzoico a partir del tolueno, de ácido tereftálico a partir del p-xileno, y de ácido ftálico a partir del o-xileno, son algunas conversiones ilustrativas a escala industrial.[30]

- La oxidación de alcoholes primarios en laboratorio se lleva a cabo con agentes oxidantes poco específicos, por ejemplo el dicromato de potasio, el reactivo de Jones, el permanganato de potasio, o el clorito de sodio. El método es adecuado en condiciones de laboratorio, comparado con el uso industrial del aire, pero este último es más ecológico, puesto que conduce a menos subproductos inorgánicos, tales como óxidos de cromo o manganeso.
- Por Deshidrogenación de alcoholes, catalizada por bases. Técnica industrial.
- Las Aldehído deshidrogenasas (EC 1.2.1.3) son un grupo de enzimas que catalizan la oxidación de aldehídos[31] (R-C(=O)-H) a ácidos carboxílicos (R-C(=O)-O-H). El oxígeno adicional proviene del agua.
- Por Oxidación de aldehídos con dioxígeno del aire, utilizando catalizadores de cobalto y manganeso.
- La hidrólisis de nitrilos es un método muy utilizado en síntesis de ácidos carboxílicos. La clave se encuentra en la síntesis del nitrilo correspondietne al ácido carboxílico deseado.
- En laboratorio, los ácidos carboxílicos también pueden obtenerse por la hidrólisis de ésteres, o amidas, obtenidos previamente mediante otros métodos (ejemplo: por Reacción de Reformatski, o Reacción de Heck), generalmente con catálisis ácida o básica.
Métodos por conexión C-C
- La carbonilación es el método de síntesis de ácidos carboxílicos más versátil cuando va acompañado a la adición de agua. Este método es efectivo para alquenos que generan carbocationes secundarios y terciarios, por ejemplo, de isobutileno a ácido piválico. En la reacción de Koch, la adición de agua y monóxido de carbono (CO) a alquenos está catalizada por ácidos fuertes. El ácido acético y el ácido fórmico son producidos por la carbonilación del metanol, llevada a cabo con yodo y alcóxido, quienes actúan como promotores, y frecuentemente con altas presiones de monóxido de carbono, generalmente involucrando varios pasos hidrolíticos adicionales, en el proceso Monsanto y el proceso Cativa, todos son procesos industriales.

- Las hidrocarboxilaciones se usan alquenos y alquinos como sustrato y se utilizan catalizadores que involucran la adición simultánea de agua y CO. Este método se usa para obtener industrialmente ácido propiónico a partir de etileno:
H2C=CH2 + H2O + CO → CH3CH2COOH. Tales reacciones son llamadas algunas veces como "Química de Reppe".Estas reacciones requieren metales de transición como el rodio como catalizadores pues se enlazan al CO y lo activan. En la síntesis industrial de Ibuprofeno, se parte de alcohol benzílico que se convierte en el correspondiente ácido carboxílico en una reacción catalizada por paladio:[32]
- ArCH(CH3)OH + CO → ArCH(CH3)COOH
- En laboratorio, la Carbonilación se lleva a cabo con un reactivo de organolitio o Grignard:
- RLi + CO2 → RCO2Li
- RCO2Li + HCl → RCO2H + LiCl

- La reacción de Kolbe-Schmitt, que provee una ruta de síntesis al ácido salicílico, precursor de la aspirina.

- La Homologación de Arndt-Eistert, es un método de síntesis que añade un grupo metileno a un ácido carboxílico (Homólogo más alto)[33][34][35] El método consiste en lo siguiente: el haluro de ácido reacciona con diazometano para dar la diazocetona. Posteriormente, en la presencia de un nucleófilo (agua) y un catalizador metálico como Ag2O, las diazocetonas forman el homólogo esperado del ácido.[36][37]
- El ácido oxálico se obtiene industrialmente por calentamiento del formiato de sodio (HCOONa) a 360 °C formándose primero el oxalato de sodio (NaOOC-COONa) y liberándose dihidrógeno (H2). Posteriormente se hace reaccionar el oxalato de sodio con una lechada de cal (disolución de hidróxido de calcio, Ca(OH)2), precipitando oxalato de calcio (Ca(COO)2). Finalmente se hace reaccionar el oxalato de calcio con ácido sulfúrico (H2SO4), formándose ácido oxálico.
- Se puede incorporar un carboxilo por unpouling por medio del anión cianuro, el cual se usa como nucleófilo (el carboxilo es electrofílico) y los halogenuros de alquilo o carbonilos como electrófilos:
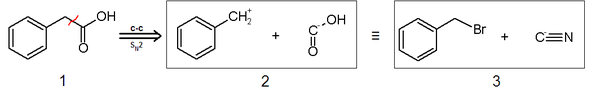
Un caso histórico del uso de este método es la síntesis de Strecker. La primera síntesis conocida de un aminoácido se realizó en 1850 en el laboratorio de Adolph Strecker en Tubingen, Alemania. Strecker añadió acetaldehído a una solución acuosa de amoniaco y ácido cianhídrico. El producto que se obtuvo fue α-amino propionitrilo, que Strecker hidrolizó a alanina racémica.[38] La síntesis de Strecker es una serie de reacciones químicas que permiten la síntesis de un α-aminoácido partiendo de un aldehído o una cetona.[39][40][41]
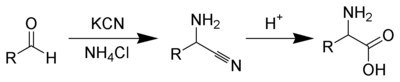
El ácido glutárico se puede preparar mediante la apertura de anillo de butirolactona con cianuro de potasio para dar una mezcla de carboxilato de potasio-nitrilo que se hidroliza para dar el diácido.[42] Alternativamente, la hidrólisis, seguida de la oxidación de dihidropirano, da el ácido glutárico.

También se puede preparar a partir de la reacción de 1,3-dibromopropano con sodio o cianuro de potasio para obtener el dinitrilo, seguido de hidrólisis.
- Un método muy versátil para obtener ácidos carboxílicos de cadena más compleja o 1,3-dicarboxílicos, es mediante la síntesis malónica.

- La química del anhídrido maleico es muy rica, lo que refleja su fácil disponibilidad y reactividad bifuncional. Es un potente dienófilo en las reacciones de Diels-Alder. Esto permite sintetizar diversos ácidos 1,4-dicarboxílicos de acuerdo a lo mostrado en el siguiente esquema:
El anhídrido maleico dimeriza en una reacción fotoquímica para formar dianhídrido ciclobutano tetracarboxílico (CBTA). La hidrólisis de este compuesto forma el ácido ciclobutano 1,2,3,4-tetracarboxílico.[43][44]
- Otro método para obtener ácidos 1,4-dicarboxílicos es por medio de la condensación de Stobbe[45] en donde se activa el carbanión de un éster o el anhídrido del ácido succínico. Se muestra el ejemplo benzofenona:[46]
Métodos por desconexión C-C
- Los grupos alquilo en un anillo bencénico se oxidan hasta el grupo carboxilo (-COOH), sin importar la longitud previa de la cadena. Así, diversos alquilbencenos se oxidan hasta su respectivo ácido benzoico. El anhídrido maleico se producía tradicionalmente por la oxidación del benceno u otros compuestos aromáticos. Su hidrólisis formaba el ácido maleico, el cual puede hidrogenarse para producir ácido succínico, fotoisomerizarse a ácido fumárico o participar en reacciones de Diels-Alder. A partir de 2006, solo unas pocas plantas más pequeñas siguen utilizando el benceno, debido al aumento del precio del benceno. Técnica industrial.

- Halogenación de metilcetonas, seguida de hidrólisis en la reacción del haloformo.
- Ruptura oxidativa de olefinas, por ozonólisis, permanganato de potasio, o dicromato de potasio.
Dieterle et al.[47] prepararon ácido adípico por la oxidación del aceite de ricino con ácido nítrico. Históricamente, el ácido adípico ha sido preparado de diferentes formas usando oxidación. Un método clásico es por la ozonólisis oxidativa del ciclohexeno. Actualmente el ácido adípico es producido por la mezcla de ciclohexanol y ciclohexanona llamada "aceite KA", que proviene de la abreviación "ketone-alcohol" ("cetona-alcohol"). El aceite KA es oxidado con ácido nítrico para procesar el ácido adípico. Al comienzo de la reacción el ciclohexanol es convertido en cetona, liberando óxido nitroso:
- HOC6H11 + HNO3 → OC6H10 + HNO2 + H2O
Entre sus varias reacciones, el ciclohexano se torna nitroso, determinando la etapa para la escisión del enlace C-C:
- HNO2 + HNO3 → NO+NO3- + H2O
- OC6H10 + NO+ → OC6H9-2-NO + H+
- Por Transposición de Favorskii: En sus investigaciones sobre la química de las cetonas α-halogenadas Favorski observó que, tratando algunas dihalocetonas alifáticas del tipo RCH2CX2COCH2 R' con hidróxido de potasio diluido se formaban ácidos carboxílicos α,β-insaturados (véase más adelante).[48]
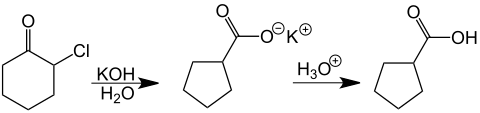
Como un ejemplo de la reacción de una monohalogenocetona, Favorskii examinó la α-clorociclohexanona, obteniendo después de la acidificación de la solución el carboxilato del ácido ciclopentanocarboxílico. Este tiempo de reacción fue especialmente notable porque fue desarrollado a partir del anillo de carbono de seis miembros a un anillo de cinco carbonos.[49][50]
Reacciones menos comunes
Muchas reacciones conducen a ácidos carboxílicos, pero son usadas solo en casos muy específicos, o principalmente son de interés académico:
- Dismutación de un aldehído en la reacción de Cannizzaro.
- Transposición de dicetonas, en la Transposición del ácido bencílico, involucrando la generación de ácidos benzoicos en la reacción de von Richter, a partir de nitrobencenos, y en la reacción de Kolbe-Schmitt, a partir de fenoles.
Reacciones
- Obtención de sales de ácidos carboxílicos y amidas a partir del ácido:
- Los ácidos carboxílicos reaccionan con bases para formar sales. En estas sales el hidrógeno del grupo -OH se reemplaza con el ion de un metal, por ejemplo Na+. De esta forma, el ácido acético reacciona con hidrogenocarbonato de sodio para dar acetato de sodio, dióxido de carbono y agua.

Entonces, luego de haber obtenido la sal, podemos calentar la misma para llegar a la amida mediante deshidratación.[51] La reacción general y su mecanismo son los siguientes:
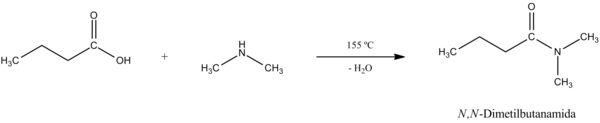


- Formación de derivados de deshidratación, como anhídridos y cetenas.
- Halogenación en la posición alfa: Llamada halogenación de Hell-Volhard-Zelinsky o también conocida como Reacción de Hell-Volhard-Zelinsky. La misma sustituye un átomo de hidrógeno en la posición alfa con un halógeno, reacción que presenta utilidad sintética debido a la introducción de buenos grupos salientes en la posición alfa.

Los grupos carboxilos reaccionan con los grupos amino para formar amidas. En el caso de aminoácidos que reaccionan con otros aminoácidos para dar proteínas, al enlace de tipo amida que se forma se denomina enlace peptídico. Igualmente, los ácidos carboxílicos pueden reaccionar con alcoholes para dar ésteres, o bien con halogenuros para dar halogenuros de ácido, o entre sí para dar anhídridos. Los ésteres, anhídridos, halogenuros de ácido y amidas se llaman derivados de ácido.
- La reacción de Varrentrapp tiene pocas aplicaciones en síntesis, pero es útil en la determinación de ciertos ácidos grasos. Consiste en la descomposición de ácidos grasos insaturados en otros de cadena más corta con desprendimiento de hidrógeno.
- En la reacción de Arndt-Eistert se inserta un metileno α a un ácido carboxílico.
Referencias
Enlaces externos
- Los ácidos carboxílicos, resumen de la Universidad Autónoma del Estado de Hidalgo.