Serpina
As serpinas son unha superfamilia de proteínas con estruturas similares que foron inicialmente identificadas pola súa actividade de inhibición de proteases e poden atoparse en todos os reinos de seres vivos.[1][2] Serpina é un acrónimo que se acuñou orixinalmente así porque as primeiras serpinas descubertas actuaban sobre as serina proteses similares á quimotripsina (que en inglés serían serine protease inhibitors = serpin).[3][4][5] Son notables polo seu mecanismo de acción infrecuente, no cal inhiben irreversiblemente as súas proteases diana ao sufriren un gran cambio conformacional para distorsionar o sitio activo da súa molécula diana.[6][7] Isto contrasta co mecanismo máis común de inhibición competitiva para inhibidores da protease que se unen e bloquea o acceso ao sitio activo da protease.[8][9]
| Serpina (inhibidor da serina protease) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Serpin, SERPIN (símbolo raíz de familia) | ||||||||||
| Pfam | PF00079 | ||||||||||
| InterPro | IPR000215 | ||||||||||
| PROSITE | PDOC00256 | ||||||||||
| SCOPe | 1hle / SUPFAM | ||||||||||
| CDD | cd00172 | ||||||||||
| |||||||||||
A inhibición de proteases feita polas serpinas controla un conxunto de procesos biolóxicos, como a coagulación e a inflamación, e consecuentemente estas proteínas son o obxectivo dunha intensa investigación médica.[10] O seu cambio conformacional peculiar tamén espertou o interese no eido da bioloxía estrutural e pregamento de proteínas.[7][8] Os mecanismos de cambio conformacional danlles certas vantaxes, pero tamén teñen inconvenientes: as serpinas son vulnerables a mutacións que poden resultar en serpinopatías como o pregamento incorrecto de proteínas e a formación de polímeros de cadea longa inactivos.[11][12] A polimerización das serpinas non só reduce a cantidade de inhibidor activo, senón que tamén causa a acumulación dos polímeros, orixinando morte celular e insuficiencia orgánica.[10]
Aínda que a maioría das serpinas controlan cadoiros proteolíticos, algunhas proteínas con estrutura de serpina non son inhibidores encimáticos, senón que realizan diversas funcións como o almacenamento (como faría a ovoalbumina na clara de ovo), transporte, como en proteínas transportadoras de hormonas (globulina fixadora de tiroxina, globulina fixadora de cortisol), e chaperonización molecular (HSP47).[9] O termo serpina utilízase para describir estes membros tamén, malia non teren función inhibitoria, xa que están evolutivamente relacionados.[1]
Historia
Informouse por primeira vez da actividade inhibitoria da protease no plasma sanguíneo a finais do século XIX,[13] pero ata a década de 1950 non se illaron as serpinas antitrombina e alfa1 antitripsina,[14] co recoñecemento posterior da súa estreita homoloxía en 1979.[15][16] Quedou claro que pertencían a unha nova familia proteica cando se comprobou o seu aliñamento coa proteína non inhibitoria da clara do ovo ovoalbumina, dando lugar á chamada superfamilia proteica alfa1-antitripsina-antitrombina III-ovalbumina de inhibidores da serina protease,[17] pero foi despois renomeada de forma máis breve como superfamilia das Serpinas.[18] A caracterización inicial da nova familia centrouse na alfa1-antitripsina, unha serpina presente nunha alta concentración no plasma sangíneo, cuxa mutación pode orixinar un trastorno xenético común que se considera a causa da predisposición á enfermidade pulmonar enfisema[19] e á cirrose hepática.[20] A identificación das mutacións S e Z[21][22] responsables da deficiencia xenética e os posteriores aliñamentos de secuencias da alfa1-antitripsina e a antitrombina en 1982 levaron ao recoñecemento das estreitas homoloxías dos sitios activos das dúas proteínas,[23][24] centrados nunha metionina[25] na alfa1-antitripsina como inhibidor da elastase tisular, e na arxinina na antitrombina[26] como inhibidor da trombina.[27]
O papel fundamental do residuo do centro activo para determinar a especificidade da inhibición das serpinas foi confirmado inequivocamente polo descubrimento de que unha mutación natural que afectaba a metionina do centro activo na alfa1-antitripsina, que se cambiaba por arxinina (como na antitrombina), tiña como resultado un grave trastorno hemorráxico.[28] Esta especificidade de centro activo da inhibición era tamén evidente nas moitas familias de inhibidores da protease[7] pero as serpinas diferían delas en que eran proteínas moito máis grandes e tamén en que posuían o que se descubriu pouco despois como unha capacidade inherente para experimentar cambios de forma. A natureza deste cambio conformacional revelouse coa determinación en 1984 da primeira estrutura cristalina dunha serpina, a da alfa1-antitripsina post-clivaxe.[29] Isto xunto coa posterior resolución da estrutura da ovoalbumina nativa (non clivada)[30] indicou que o mecanismo inhibitorio das serpinas implicaba un notable cambio conformacional, no cal se producía o movemento do bucle peptídico exposto que contén o sitio reactivo e a súa incorporación como unha febra que quedaba en posición intermedia na folla beta-pregada principal que caracteriza a molécula de serpina.[31][32] As primeiras evidencias do papel esencial do movemento deste bucle no mecanismo inhibitorio procederon do descubrimento de que incluso aberracións menores nos residuos de aminoácidos que forman a bisagra por onde se move na antitrombina tiñan como resultado unha enfermidade trombótica.[31][33] A confirmación final do desprazamento ligado da protease diana por causa deste mvemento do bucle proporcionouna en 2000 ocoñecemento da estrutura do complexo post-inhibitorio da alfa1-antitripsina con tripsina,[6] mostrando como o desprazamento resulta na deformación e inactivación da protease unida. Estudos estruturais posteriores revelaron unha vantaxe adicional do mecanismo conformacional[34] para permitir a modulación sutil da actividade inhibitoria, como se viu en particular a nivel tisular[35] coas serpinas funcionalmene diversas do plasma humano.
Ata agora identificáronse unhas 1000 serpinas, incluíndo 36 proteínas humanas, así como moléculas en todos os reinos da vida (animais, plantas, fungos, bacterias e arqueas) e nalgúns virus (Poxviridae).[36][37][38] A característica central de todos é unha armazón estreitamente conservada, que permite o aliñamento preciso dos seus compoñentes estruturais e funcionais baseados na estrutura molde da alfa1-antitripsina.[39] Na década de 2000, presentouse unha nomenclatura sistemática para categorizar os membros da superfamilia da serpina baseada nas súas relacións evolutivas.[1] As serpinas son, polo tanto, a superfamilia máis grande e diversa de inhibidores de proteases.[40]
Actividade

A maioría das serpinas son inhibidores da protease, que afectan a serina proteases similares á quimotripsina extracelulares. Estas proteases posúen un resido de serina nucleófilo nunha tríade catalítica no seu sitio activo. Exemplos son a trombina, tripsina e a elastase do neutrófilo humana.[41] As serpinas actúan como inhibidores suicidas irreversibles ao atraparen un intermediario do mecanismo catalítico da protease.[6]
Algunhas serpinas inhiben outras clases de proteases, tipicamente cisteína proteases, e denomínanse "inhibidores de clase cruzada". Estes encimas difiren das serina proteases en que usan un residuo nucleófilo de cisteína, en vez dunha serina, no seu sitio activo.[42] Non obstante, a química encimática é similar, e o mecanismo de inhibición polas serpinas é o mesmo en ambas as clases de proteases.[43] Exemplos de serpinas inhibitorias de clase cruzada son a serpina B3 (antíxeno 1 de carcinoma de célula escamosa ou SCCA1),[44] e a serpina aviaria proteína específica do estado de terminación nuclear mieloide e eritroide (MENT), as cales inhiben ambas as cisteína proteases similares á papaína.[45][46][47]
Localización e función biolóxica
Inhibición da protease
Aproximadamente dous terzos das serpinas humanas realizan funcións extracelulares, inhibindo as proteases na circulación sanguínea para modular as súas actividades. Por exemplo, as serpinas extracelulares regulan os cadoiros proteolíticos esenciais para a coagulación do sangue (antitrombina), as respostas inflamatorias e inmunes (antitripsina, antiquimotripsina e o inhibidor de C1) e remodelación de tecidos (PAI-1).[9] Ao inhibiren as proteases de cadoiros de sinalización, poden tamén afectar o desenvolvemento.[48][49] A táboa das serpinas humanas (abaixo) proporciona exemplos do rango de funcións realizadas polas serpinas humanas, así como algunhas das enfermidades que resultan da deficiencia de serpinas.
As proteases que son diana das serpinas inhibitorias intracelulares foron difíciles de identificar, xa que moitas destas moléculas parecen realizar funcións solapadas. Ademais, moitas serpinas humanas carecen de equivalentes funcionais precisos en organismos modelos como o rato. Non obstante, unha función importante das serpinas intracelulares pode ser protexer contra a actividade inapropiada das proteases dentro da célula.[50] Por exemplo, unha das serpinas humanas mellor caracterizadas é Serpina B9, que inhibe a protease grancima B dos gránulos citotóxicos. Facendo isto, a Serpina B9 pode protexer contra a liberación inadvertida de grancima B e a activación prematura ou non desexada das vías de morte celular.[51]
Algúns virus usan as serpinas para interferir coas funcións das proteases do seu hóspede. A serpina viral da varíola das vacas CrmA (modificador da resposta de citocinas A) utilízase para evitar as respostas inflamatorias e apoptóticas de células hóspede infectadas. A CrmA incrementa a infectividade ao suprimir a resposta inflamatoria do hóspede por medio da inhibición do procesamento da IL-1 e IL-18 pola cisteína protease caspase-1.[52] En eucariotas, unha serpina de plantas inhibe ambas as metacaspases[53] e unha cisteína protease similar á papaína.[54]
Funcións non inhibitorias
As serpinas extracelulares non inhibitorias tamén realizan unha ampla variedade de funcións importantes. A globulina fixadora da tiroxina e a transcortina transportan as hormonas tiroxina e cortisol, respectivamente.[55][56] A serpina non inhibitoria ovoalbumina é a proteína máis abundante da xema de ovo. A súa función exacta é descoñecida, pero pénsase que é unha proteína de almacenamento para o desenvolvemento do embrión.[57] A serpina de choque térmico 47 é unha chaperona, esencial para o correcto pregamento do coláxeno. Actúa estabilizando a tripla hélice do coláxeno mentres está sendo procesado no retículo endoplasmático.[58]
Algunhas serpinas son á vez inhibidores da protease e realizan funcións adicionais. Por exemplo, o inhibidor da cisteína protease nuclear MENT, en aves tamén actúa como molécula remodeladora da cromatina nos eritrocitos de aves.[46][59]
Estrutura
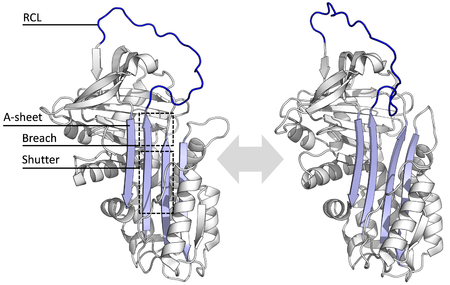
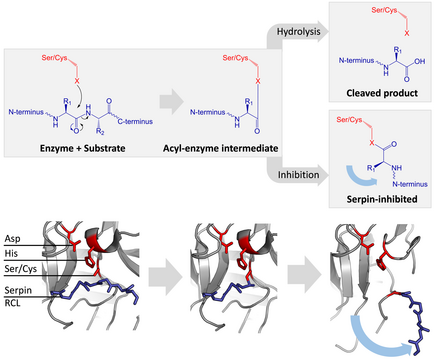
Todas as serpinas comparten unha estrutura (ou pregamento) común, malia as variadas funcións que teñen. Todas teñen caracteristicamente tres follas β (denominadas A, B e C) e oito ou nove hélices α (denominadas hA–hI).[29][30] As rexións máis significativas para a función das serpinas son a folla A e o bucle do centro reactivo (RCL). A folla A inclúe dúas febras β que están nunha orientación paralela cunha rexión entre elas chamada a "persiana" (shutter), e unha rexión superior chamada a "fisura" (breach). O RCL forma a interacción inicial coa protease diana en moléculas inhibitorias. Resolvéronse algunhas estruturas que mostraban o RCL completamente exposto ou parcialmente inserido na folla A, e pénsase que as serpinas están en equilibrio dinámico entre estes dous estados.[8] O RCL só establece interaccións temporais co resto da estrutura, e é, polo tanto, moi flexible e está exposto ao solvente.[8]
As estruturas que se determinaron das serpinas son de varias conformacións diferentes, o cal foi necesario para o coñecemento do seu mecanismo de acción de varios pasos. A Bioloxía estrutural exerceu un papel fundamental no coñecemento da función e bioloxía das serpinas.[8]
Cambio conformacional e mecanismo inhibitorio
As serpinas inhibitorias non inhiben as súas proteases diana polo típico mecanismo de inhibición competitiva (pechadura e chave) usado pola maioría dos inhibidores de proteases pequenos (por exemplo, inhibidores de tipo Kunitz). En vez diso, as serpinas usan un cambio conformacional pouco común, que distorsiona a estrutura da protease e impide que complete a súa catálise. O cambio conformacional implica que o RCL se mova ao extremo oposto da proteína e se insira na folla β A, formando unha fibra β extra antiparalela. Isto cambia a serpina desde o estado estresado ao estado relaxado de baixa enerxía (transición de S a R).[7][8][62]
As serina proteases e cisteína proteases catalizan a rotura do enlace peptídico nun proceso en dúas etapas. Inicialmente, o residuo catalítico da tríade do sitio activo realiza un ataque nucleófilo no enlace peptídico do substrato. Isto libera o novo N-terminal e forma un enlace éster covalente entre o encima e o substrato.[7] Este complexo covalente entre encima e substrato chámase intermediario acil-encima. Para substratos estándar, o enlace éster é hidrolizado e o novo C-terminal libérase para completar a catálise. Porén, cando unha serpina é cortada por unha protease, rapidamente sofre a transición de S a R antes de que o intermediario acil-encima se hidrolice.[7] A eficiencia da inhibición depende de que a velocidade cinética relativa do cambio conformacional é varias ordes de magnitude máis rápida que a hidrólise pola protease.
Como o RCL aínda está ligado covalentemente á protease polo enlace éster, a transición de S a R empurra a protease desde a parte superior á inferior da serpina e distorsiona a tríade catalítica. A protease distorsionada só pode hidrolizar o intermediario acil-encima de maneira extremadamente lenta e así a protease permanece ligada covalentemente por días ou semanas.[6] As serpinas clasifícanse como inhibidores irreversibles e como inhibidores suicidas, xa que cada proteína serpina inactiva permanentemente unha soa protease e só pode funcionar unha vez.[7]
Activación alostérica

A mobilidade conformacional das serpinas proporciona unha vantaxe clave sobre os inhibidores da protease de pechadura e chave estáticos.[34] En concreto, a función das serpinas inhibitorias pode ser regulada por interaccións alostéricas con cofactores específicos. As estruturas cristalinas de raios X da antitrombina, cofactor II da heparina, MENT e a antiquimotripsina murina revelan que estas serpinas adoptan unha conformación na que os primeiros dous aminoácidos do RCL se insiren na parte superior da folla β A. A conformación parcialmente inserida é importante porque algúns cofactores poden cambiar conformacionalmente certas serpinas parcialmente inseridas a unha forma completamente expulsada.[63][64] Este rearranxo conformacional fai que as serpinas sexan uns inhibidores máis efectivos.
O exemplo arquetípico desta situación é a antitrombina, que circula no plasma nun estado relativamente inactivo inserido parcialmente. A especificidade primaria que determina o residuo (a arxinina P1) apunta cara ao corpo da serpina e non queda dispoñible para a protease. Despois de unirse a unha secuencia pentasacárida de alta afinidade da heparina de cadea longa, a antitrombina sofre un cambio conformacional, a expulsión do RCL e a exposición da arxinina P1. A forma unida ao pentasacárido da heparina da antitrombina é, así, un inhibidor máis efectivo da trombina e o factor Xa.[65][66] Ademais, ambas as proteases da coagulación mencionadas conteñen tamén sitios de unión (chamados exositios) para a heparina. Polo tanto, a heparina tamén actúa como molde que se une tanto á protease coma á serpina, o que acelera drasticamente a interacción entre as dúas partes. Despois da interacción inicial, o complexo da serpina final está formado e o residuo de heparina é liberado. Esta interacción é fisioloxicamente importante. Por exemplo, despois dunha lesión nas paredes dos vasos sanguíneos, a heparina queda exposta e a antitrombina é activada para controlar a resposta coagulatoria. A comprensión das bases moleculares desta interacción permitiu o desenvolvemento do Fondaparinux, unha forma sintética do pentasacárido da heparina usada como fármaco anticoagulante.[67][68]
Conformación latente

Certas serpinas sofren espontaneamente a transición de S a R sen que fosen previamente cortadas por unha protease, para formar unha conformación denominada estado latente. As serpinas latentes non poden interaccionar con proteases, polo que xa non son inhibidores da protease. O cambio conformacional á latencia non é exacteamente o mesmo que a transcición de S a R dunha serpina clivada. Como o RCL aínda está intacto, a primeira febra da folla C ten que "pelarse" ou separarse para permitir a inserción completa do RCL.[69]
A regulación da transición á latencia poden actuar como un mecanismo de control nalgunhas serpinas, como a PAI-1. Aínda que a PAI-1 se produce na conformación S inhibitoria, "autoinactívase" polo cambio ao estado latente a menos que se una ao cofactor vitronectina.[69] De xeito similar, a antitrombina pode tamén converterse espontaneamente ao estado latente, como un mecanismo de modulación adicional para a súa activación alostérica pola heparina.[70] Finalmente, cómpre o N-terminal da tengpina, unha serpina de Thermoanaerobacter tengcongensis, para bloquear a molécula no estado inhibitorio nativo. A distorsión das interaccións feitas pola rexión N-terminal ten como resultado un cambio conformacional espontáneo desta serpina á conformación latente.[71][72]
Cambio conformacional en funcións non inhibitorias
Certas serpinas non inhibitorias tamén usan o cambio conformacional como parte do seu funcionamento. Por exemplo, a forma nativa (S) da globulina fixadora da tiroxina ten unha alta afinidade pola tiroxina, mentres que a forma clivada (R) ten baixa afinidade. De xeito similar, a transcortina ten unha maior afinidade polo cortisol cando está no seu estao nativo (S) que cando está no estado clivado (R). Deste modo, nestas serpinas, a clivaxe do RCL e a transición de S a R foron utilizadas para permitir a liberación do ligando en lugar de para a inhibición da protease.[55][56][73]
Nalgunhas serpinas, a transición de S a R pode activar eventos de sinalización celular. Nestes casos, unha serpina que formou un complexo coa súa protease diana, é despois recoñecida por un receptor. O evento de unión despois acaba orixinando a sinalización augas abaixo polo receptor.[74] A transición de S a R é, polo tanto, usada para alertar as células da presenza da actividade de protase.[74] Isto difire do mecanismo usual no que as serpinas afectan a sinalización simplemente por inhibiren as proteases implicadas no cadoiro de sinalización.[48][49]
Degradación
Cando unha serpina inhibe unha protease diana, forma un complexo permanente que debe ser eliminado. Para as serpinas extracelulares, os complexos finais serpina-encima son retirados rapidamente da circulación. Un mecanismo polo cal isto ocorre en mamíferos é por medio da proteína relacionada co receptor da lipoproteína de baixa densidade (LRP), que se une a complexos inhibitorios creados pola antitrombina, a PA1-1 e a neuroserpina, causando a súa captación celular.[74][75] De maneira semellante, a serpina necrótica de Drosophila degrádase no lisosoma despois de ser transportada á célula polo receptor de lipoforina-1 (homólogo da familia do receptor de LDL de mamíferos).[76]
Enfermidades e serpinopatías
As serpinas están envolvidas nunha ampla variedade de funcións fisiolóxicas, e por iso as mutacións nos xenes que os codifican poden causar diversas doenzas. As mutacións que cambian a actividade, especificidade ou propiedades de agregación das serpinas afectan como estas funcionan. A maioría das doenzas relacionadas coas serpinas son o resultado da polimerización das serpinas en agregados, aínda que tamén ocorren outros tipos de mutacións ligadas a enfermidades.[8][77] O trastorno deficiencia de alfa1 antitripsina é unha das enfermidades hereditarias máis comúns.[11][78]
Inactividade ou ausencia
Como o pregamento de serpina estresado é de alta enerxía, as mutacións poden causar que cambien incorrectamente ás súas conformacións de baixa enerxía (por exemplo, a relaxada ou latente) antes de que realizasen debidamente o seu papel inhibitorio.[10]
As mutacións que afectan a taxa ou extensión da inserción do RCL na folla A poden causar que a serpina experimente o seu cambio conformacional de S a R antes de interaccionar cunha protease. Como unha serpina só pode facer este cambio conformacional unha vez, a serpina errada resultante é inactiva e incapaz de controlar axeitadamente á súa protease diana.[10][79] Igualmente, as mutacións que promoven unha transición inapropiada ao estado latente monómero causan enfermidades ao reduciren a cantidade de serpina inhibitoria activa. Por exemplo, as variantes das antitrombina ligadas a enfermidades Wibble e Wobble,[80] promoven ambas a formación do estado latente.
A estrutura do mutante ligado a enfermidades da antiquimotripsina (L55P) revelou outra "conformación δ" inactiva. Na conformación δ, catro residuos do RCL están inseridos na parte superior da folla β A. A metade inferior da folla está chea como resultado de que unha das hélices α (a hélice F) pasou parcialmente a unha conformación de febra β, completando os enlaces de hidróxeno da folla β.[81] Non está claro se outras serpinas poden adoptar este confórmero e se esta conformación ten un papel funcional, mais especúlase que a globulina fixadora da tiroxina pode adoptar a conformación δ durante a liberación da tiroxina.[56] As proteínas non inhibitorias relacionadas coas serpinas poden tamén causar doenzas cando están mutadas. Por exemplo, as mutación na SERPINF1 causan osteoxénese imperfecta tipo VI en humanos.[82]
En ausencia da serpina necesaria, a protease que normalmente regularía está sobreactiva, o que orixina patoloxías.[10] En consecuencia, unha simple deficiencia nunha serpina (por exemplo, unha mutación nula) pode ter como resultado unha enfermidade.[83] Utilízanse knockouts de xenes, especialmente os de ratos, para determinar experimentalmente as funcións normais das serpinas polos efectos observados na súa ausencia.[84]
Cambio de especificidade
Nalgúns raros casos, un só cambio de aminoácido nun RCL de serpina altera a súa especificidade de modo que toma como diana unha protease errada. Por exemplo, a mutación Antitripsina-Pittsburgh (M358R) causa que a serpina α1-antitripsina inhiba a trombina, causando un trastorno hemorráxico.[28]
Polimerización e agregación
A maioría das enfermidades debidas a serpinas prodúcense por agregación de proteínas e denomínanse "serpinopatías".[12][81] As serpinas son vulnerables a mutacións que causan enfermidades que promoven a formación de polímeros mal pregados debido ás súas estruturas inherentemente inestables.[81] Entre as serpinopatías ben caracterizadas están a deficiencia de α1-antitripsina (alfa1), que pode causar o enfisema familiar, e ás veces cirrose hepática, certas formas familiares de trombose relacionadas coa deficiencia de antitrombina, anxioedema hereditario tipos 1 e 2 relacionados coa deficiencia do inhibidor de C1, e a encefalopatía familiar con corpos de inclusión de neuroserpina (FENIB; un tipo raro de demencia causada pola polimerización da neuroserpina).[11][12][85]
Cada monómero do agregado de serpina encóntrase na conformación relaxada inactiva (co RCL inserido na folla A). Os polímeros son, pois, hiperestables á temperatura e incapaces de inhibir proteases. Polo tanto, as serpinopatías causan patoloxías de xeito similar a outras proteopatías (por edxemplo, enfermidades de prións) por medio de dous mecanismos.[11][12] Primeiro, a falta de serpina activa ten como resultado unha actividade de protease incontrolada e destrución dos tecidos. Segundo, os propios polímeros hiperestables entupen o retículo endoplasmático de células que sintetizan serpinas, resultando finalmente na morte celular e danos nos tecidos. No caso da deficiencia da antitripsina, os polímeros de antitripsina causan a morte de células hepáticas, ás veces dando lugar a danos hepáticos e cirrose. Dentro da célula, os polímeros de serpina son retirados lentamente por degradación no retículo endoplasmático.[86] Porén, os detalles e como os polímeros de serpina causan a morte celular aínda non se comprenden completamente.[11]
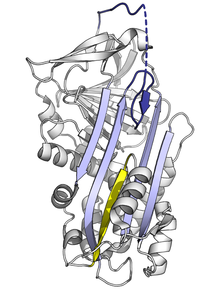
Pénsase que os polímeros de serpina fisiolóxicos se forman por eventos de intercambio de dominios, onde un segmento dunha proteína serpina se insire noutro.[87] Os intercambios de dominios ocorren cando as mutacións ou factores ambientais interfiren cos estados finais do pregamento das serpinas ao estado nativo, causando que os intermediarios de alta enerxía se preguen mal.[88] Resolvéronse tanto as estruturas de intercambio de dominios dímeras coma trímeras. No dímero (da antitrombina), o RCL e parte da folla A incorpórase na folla A doutra molécula de serpina.[87] O trímero con intercambio de dominios (da antitripsina) fórmase polo intercambio dunha rexión totalmente diferente da estrutura, a folla B (co RCL de cada molécula inserido na súa propia folla A).[89] Tamén se propuxo que as serpinas poden formar intercambios de dominios inserindo o RCL dunha proteína na folla A doutra (polimerización de folla A).[85][90] Estas estruturas dímeras e trímeras de intercambio de dominios pénsase que son os bloques de construción dos agregados de polímeros que causan enfermidades, pero o mecanismo exacto aínda non está claro.[87][88][89][91]
Estratexias terapéuticas
Están utilizándose ou investigándose varias estratexias terapéuticas para tratar a serpinopatía máis común: a deficiencia de antitripsina.[11] A terapia de aumento da antitripsina está aprobada para o enfisema relacionado coa deficiencia de antitripsina grave.[92] Nesta terapia, a antitripsina é purificada do plasma sanguíneo de doantes de sangue e administrada por vía intravenosa (comercializada inicialmente como Prolastin).[11][93] O transplante de pulmón e fígado demostrou ser efectivo para tratar a enfermidade relacionada coa deficiencia de antitripsina grave.[11][94] En modelos animais, o gene targeting en células nais pluripotentes inducidas foi utilizado con éxito para corrixir un defecto de polimerización de antitripsina e para restaurar a capacidade do fígado dos mamíferos de segregar antitripsina activa.[95] Tamén se desenvolveron pequenas moléculas que bloquean a polimerización da antitripsina in vitro.[96][97]
Evolución
As serpinas son a superfamilia de inhibidores de proteases máis grande e máis amplamente distribuída.[1][40] Pensouse inicialmente que estaban restrinxidas a organismos eucariotas, pero despois atopáronse en bacterias, arqueas e algúns virus.[36][37][98] Segue sen estar claro se os xenes procariotas son os descendentes dunha serpina procariota ancestral ou son o produto da transferencia horizontal de xenes desde os eucariotas. A maioría das serpinas intracelulares pertencen a un só clado filoxenético, tanto se proceden de plantas coma de animais, o que indica que as serpinas intra e extracelulares puideron diverxer antes de que o fixesen as plantas e os animais.[99] Excepcións son a serpina de choque térmico intracelular HSP47, que é unha chaperona esencial para conseguir o correcto pregamento do coláxeno, e cicla entre o cis-Golgi e o retículo endoplasmático.[58]
Pénsase que a inhibición de proteases é a súa función ancestral, e os membros non inhibitorios resultarían da neofuncionalización evolutiva da estrutura. O cambio conformacional de S a R tamén foi adaptado por algunhas serpinas ligadoras para regular a afinidade polas súas dianas.[56]
Distribución
Animal
Humanos
O xenoma humano codifica 16 clados de serpinas, denominadas por orde alfabética desde serpinA a serpinP, incluíndo 29 proteínas serpina inhibitorias e 7 non inhibitorias.[9][84] O sistema de nomenclatura das serpinas humanas está baseado nunha análise filoxenética de aproximadamente 500 serpinas feito desde 2001, con proteínas chamadas serpinXY, onde X é o clado da proteína e Y é o número da proteína dentro do clado.[1][36][84] As funcións das serpinas humanas foron determinadas por unha combinación de estudos bioquímicos, trastornos xenéticos humanos, e modelos de ratos knockout.[84]
| Nome do xene | Nome común | Localización | Función / Actividade[9][84] | Efecto da deficiencia[9][84] | Enfermidade humana | Localización cromosómica | Estrutura da proteína |
|---|---|---|---|---|---|---|---|
| SERPINA1 | α1-antitripsina | Extracelular | Inhibidor da elastase de neutrófilo humana.[100] O fragmento C-terminal da SERPINA1 clivada pode inhibir a infección polo VIH-1.[101] | A deficiencia ten como resultado enfisema, a polimerización causa cirrose (serpinopatía).[11][102] | 14q32.1 | 1QLP, 7API, 1D5S | |
| SERPINA2 | Proteína relacionada coa antitripsina | Extracelular | Posible pseudoxene.[103] | 14q32.1 | |||
| SERPINA3 | α1-antiquimotripsina | Extracelular | Inhibidor da catepsina G.[104] Funcións adicionais na condensación da cromatina en células hepáticas.[105] | A mala regulación ten como resultado a enfermidade de Alzheimer (serpinopatía).[106] | 14q32.1 | 1YXA, 2ACH | |
| SERPINA4 | Calistatina | Extracelular | Inhibidor da calicreína, regulador da función vascular.[107][108] | A depleción en ratas hipertensivas exacerba as lesións renais e cardiovasculares.[109] | 14q32.1 | ||
| SERPINA5 | Inhibidor da proteína C | Extracelular | Inhibidor da proteína C activa.[110] Papel intracelular de impedir a fagocitose das bacterias.[111] | O knockout en ratos macho causa infertilidade.[112] A acumulación ocorre en placas activas crónicas na esclerose múltiple.[113] | 14q32.1 | 2OL2, 3B9F | |
| SERPINA6 | Transcortina | Extracelular | Non inhibitoria. Únese ao cortisol.[55] | Deficiencia asociada coa fatiga crónica.[114] | 14q32.1 | 2V6D, 2VDX, 2VDY | |
| SERPINA7 | Globulina fixadora da tiroxina | Extracelular | Non inhibitoria. Únese á tiroxina.[56] | A deficiencia causa hipotiroidismo.[115][116] | Xq22.2 | 2CEO, 2RIV, 2RIW | |
| SERPINA8 | Anxiotensinóxeno | Extracelular | Non inhibitoria, a clivaxe pola renina causa a liberación da anxiotensina I.[117] | O knockout en ratos causa hipotensión.[118] | Variantes ligadas coa hipertensión.[119][120][121] | 1q42-q43 | 2X0B, 2WXW, 2WXX, 2WXY, 2WXZ, 2WY0, 2WY1 |
| SERPINA9 | Centerina / GCET1 | Extracelular | Inhibitoria, mantemento de células B virxes.[122][123] | Fortemente expresada na maioría dos linfomas de células B.[124][125] | 14q32.1 | ||
| SERPINA10 | Inhibidor da protease relacionado con proteína Z | Extracelular | Únese á proteína Z e inactiva o factor Xa e o factor XIa.[126] | 14q32.1 | 3F1S, 3H5C | ||
| SERPINA11 | – | Probablemente extracelular | Descoñecida | 14q32.13 | |||
| SERPINA12 | Vaspina | Extracelular | Inhibidor da calicreína-7. Adipocitocina sensibilizante á insulina.[127] | Os altos niveis plasmáticos están asociados coa diabetes tipo II.[128] | 14q32.1 | 4IF8 | |
| SERPINA13 | – | Probablemente extracelular | Descoñecido | 14q32 | |||
| SERPINB1 | Inhibidor da elastase do neutrófilo monocito | Intracelular | Inhibidor da elastase do neutrófilo.[129] | O knockout en ratos causa o defecto de supervivencia de neutrófilos e deficiencia inmune.[130] | 6p25 | 1HLE | |
| SERPINB2 | Inhibidor do activador do plasminóxeno 2 | Intracelular/extracelular | Inhibidor do uPA extracelular. A función intracelular non está clara, pero pode protexer contra a infección viral.[131] | A deficiencia en ratos reduce a resposta inmune á infección por nematodos.[132] O knockout en ratos non causa un fenotipo obvio.[133] | 18q21.3 | 1BY7 | |
| SERPINB3 | Antíxeno 1 de carcinoma de célula escamosa (SCCA1) | Intracelular | Inhibidor de cisteína proteases similares á papaína[45] e as catepsinas K, L e S.[134][135] | O knockout en ratos da Serpinb3a (o homólogo murino das SERPINB3 e SERPINB4 humanas) reduce a produción de moco nun modelo murino de asma.[136] | 18q21.3 | 2ZV6 | |
| SERPINB4 | Antíxeno 2 de carcinoma de célula escamosa (SCCA2) | Intracelular | Inhibidor de serina proteases similares á quimotripsina, catepsina G e quimase.[135][137] | O knockout en ratos da Serpinb3a (o homólogo murino das SERPINB3 e SERPINB4 humanas) reduce a produción de moco nun modelo murino de asma.[136] | 18q21.3 | ||
| SERPINB5 | Maspina | Intracelular | Non inhibitoria, función pouco clara[138][139][140] (ver tamén maspina) | O knockout en ratos indicou orixinalmente que era letal,[141] pero posteriomente mostrou non ter un fenotipo obvio.[140] A expresión pode ser un indicador prognóstico que reflicte a expresión dun xene supresor de tumores veciño (a fosfatase PHLPP1).[140] | 18q21.3 | 1WZ9 | |
| SERPINB6 | PI-6 | Intracelular | Inhibidor da catepsina G.[142] | O knockout en ratos causa perda de audición[143] e unha suave neutropenia.[144] | A deficiencia está asociada coa perda de audición.[145] | 6p25 | |
| SERPINB7 | Megsina | Intracelular | Implicado na maduración dos megacariocitos.[146] | A sobreexpresión en ratos causa enfermidade renal.[147] O knockout en ratos non causa anormalidades histolóxicas.[147] | As mutacións asociadas coa queratose palmoplantar tipo Nagashima.[148] | 18q21.3 | |
| SERPINB8 | PI-8 | Intracelular | Possible inhibidor da furina.[149] | 18q21.3 | |||
| SERPINB9 | PI-9 | Intracelular | Inhibidor do gránulo citotóxico da protease grancima B.[150] | O knockout en ratos causa disfunción immune.[151][152] | 6p25 | ||
| SERPINB10 | Bomapina | Intracelular | Descoñecido[153] | O knockout en ratos non causa e fenotipo obvio (C57/BL6; cepa de laboratorio BC069938). | 18q21.3 | ||
| SERPINB11 | Intracelular | Descoñecido[154] | A Serpinb11 murina é un inhibidor activo, mentres que o ortólogo humano é inactivo.[154] A deficiencia en ponis está asociada coa enfermidade da separación da parede do casco.[155] | 18q21.3 | |||
| SERPINB12 | Yukopina | Intracelular | Descoñecido[156] | 18q21.3 | |||
| SERPINB13 | Hurpina/Headpina | Intracelular | Inhibidor de cisteína proteases similar a papaína.[157] | 18q21.3 | |||
| SERPINC1 | Antitrombina | Extracelular | Inhibidor da coagulación, especificamente do factor X, factor IX e trombina.[34] | Os knockouts en ratos son letais.[158] | A deficiencia ten como resultado a trombose e outros trastornos de coagulación (serpinopatía).[159][160] | 1q23-q21 | 2ANT, 2ZNH, 1AZX, 1TB6, 2GD4, 1T1F |
| SERPIND1 | Cofactor II da heparina | Extracelular | Inhibidor da trombina.[161] | Os knockouts en ratos son letais.[162] | 22q11 | 1JMJ, 1JMO | |
| SERPINE1 | Inhibidor do activador do plasminóxeno 1 | Extracelular | Inhibidor da trombina, uPA e TPa.[163] | 7q21.3-q22 | 1DVN, 1OC0 | ||
| SERPINE2 | Nexina derivada da glía / Protease nexina I | Extracelular | Inhibidor de uPA e tPA.[164] | A expresión anormal leva á infertilidade do macho en ratos.[165] O knockout en ratos causa epilepsia.[166] | 2q33-q35 | 4DY0 | |
| SERPINF1 | Factor derivado do epitelio pigmentado | Extracelular | Potente molécula antianxioxénica non inhibidora.[167] A PEDF únese ao glicosaminoglicano hialurona.[168] | O knockout en ratos afecta aos vasos sanguíneos e a masa do páncreas e próstata.[167] Promove a renovación dependente de Notch das células nais neurais periventriculares adultas.[169] As mutacións en humanos causan osteoxénese imperfecta tipo VI.[82] | 17p13.3 | 1IMV | |
| SERPINF2 | α2-antiplasmina | Extracelular | Inhibidor da plasmina, inhibidor da fibrinólise.[170] | Os knockouts en ratos mostran en ratos un incremento da fibrinólise pero non trastornos hemorráxicos.[171] | A deficiencia causa un raro trastorno hemorráxico.[172][173] | 17pter-p12 | 2R9Y |
| SERPING1 | Inhibidor do Complemento 1 | Extracelular | Inhibidor da esterase C1.[174] | Varios polimorfismos asociados coa dexeneración macular[175] e o anxioedema hereditario.[176] | 11q11-q13.1 | 2OAY | |
| SERPINH1 | Proteína de choque térmico de 47 kDa (HSP47) | Intracelular | Non inhibidora, chaperona molecular no pregamento do coláxeno.[58] | Os knockouts en ratos son letais.[177] | A mutación en humanos causa osteoxénese imperfecta grave.[178][179] | 11p15 | 4AXY |
| SERPINI1 | Neuroserpina | Extracelular | Inhibidor do tPA, uPA e plasmina.[180] | A mutación causa a demencia FENIB (serpinopatía).[181][182] | 3q26 | 1JJO, 3FGQ, 3F5N, 3F02 | |
| SERPINI2 | Pancpina | Extracelular | Descoñecida[183] | A deficiencia en ratos causa insuficiencia pancreática pola perda de células acinares.[184] | 3q26 |
Serpinas de mamíferos especializadas
Identificáronse moitas serpinas de mamíferos que non comparten unha ortoloxía obvia coas serpinas correspondentes humanas. Son exemplos as numerosas serpinas de roedores (especialmente algunhas das serpinas intracelulares murinas) así como as serpinas uterinas. O termo serpina uterina aplícase a membros do clado da serpina A que están codificados polo xene SERPINA14. As serpinas uterinas prodúcense no endometrio dun grupo restrinxido de mamíferos do clado Laurasiatheria baixo a influencia da proxesterona ou estróxeno.[185] Probablemente non son inhibidores das proteases funcionais e poderían funcionar durante o embarazo para inhibiren as respostas inmunes maternas contra o concepto ou participaren no transporte transplacentario.[186]
Insectos
O xenoma de Drosophila melanogaster contén 29 xenes que codifican serpinas. A análise das secuencias de aminoácidos serviu para situar 14 destas serpinas no clado Q das serpinas e 3 no clado K, mentres que as 12 restantes se clasifican como serpinas orfas que non pertencen a ningún clado.[187] O sistema de clasificación de clados é difícil de usar para as serpinas de Drosophila e no seu lugar adoptouse un sistema de nomenclatura baseado na posición dos xenes das serpinas nos cromosomas de Drosophila. Trece das serpinas de Drosophila aparecen como xenes illados no xenoma (incluíndo a Serpina-27A, ver máis abaixo), e as 16 restantes están organizadas en cinco agrupacións de xenes que se encontran nas posicións cromosómicas 28D (2 serpinas), 42D (5 serpinas), 43A (4 serpinas), 77B (3 serpinas) e 88E (2 serpinas).[187][188][189]
Estudos das serpinas de Drosophila revelan que a Serpina-27A inhibe a proteasee Easter (a protease final no cadoiro proteolítico de Nudel, Gastrulation Defective, Snake e Easter) e así controla os padróns dorsoventrais. Easter funciona clivando Spätzle (un ligando de tipo quimoquina), o que ten como resultado a sinalización mediada por Toll. Ademais do seu papel central no establecemento dos padróns embrionarios, a sinalización de Toll é tamén importante para a resposta inmunitaria innata en insectos. Por conseguinte, a serpina-27A tamén funciona controlando a resposta inmune dos insectos.[49][190][191] No coleóptero Tenebrio molitor unha proteína (SPN93) que comprende dous dominios de serpina dispostos en tándem funciona regulando o cadoiro proteolítico de Toll.[192]
Nematodos
O xenoma do verme nematodo Caenorhabditis elegans contén 9 serpinas, todas as cales carecen de secuencia sinal e, polo tanto, son probablemente intracelulares.[193] Porén, só 5 destas serpinas parecen funcionar como inhibidores das proteases.[193] Unha, a SRP-6, realiza unha función protectora contra a distorsión lisosómica asociada á calpaína inducida polo estrés. Ademais, a SRP-6 inhibe as cisteína proteases lisosómicas liberadas despois da rotura do lisosoma. En consecuencia, os vermes que carecen de SRP-6 son sensible ao estrés. Hai que salientar que os vermes knockout para SRP-6 morren cando se meten en auga (o fenotipo de estrés hipoosmótico letal ou Osl). Suxeriuse, polo tanto, que os lisosomas xogan un papel xeral e controlable na determinación do destino celular.[194]
Plantas
As serpinas de plantas estaban entre os primeiros membros da superfamilia que se identificaron.[195] A serpina proteína Z da cebada é moi abundante no gran de cebada e é un dos compoñentes proteicos principais na cervexa. O xenoma da planta modelo Arabidopsis thaliana contén 18 xenes similares aos das serpinas, aínda que só 8 deles teñen secuencias de serpina de lonxitude completa.
As serpinas de plantas son potentes inhibidores das serina proteases similares á quimotripsina de mamíferos in vitro, o exemplo mellor estudado é a serpina ZX da cebada (BSZx), que pode inhibir a tripsina e quimotripsina, así como varios factores de coagulación do sangue.[196] Porén, as plantas carecen de parentes próximos das serina proteases similares á quimotripsina. O RCL de varias serpinas do trigo e centeo conteñen secuencias repetidas poli-Q similares ás presentes nas proteínas de almacenamento prolaminas do endosperma.[197][198] Polo tanto, suxeriuse que as serpinas de plantas poden funcionar inhibindo proteases de insectos ou microbios que doutro modo dixerirían as proteínas de almacenamento dos grans de cereais. Un apoio para esta hipótese é que se identificaron serpinas específicas de plantas no zume do floema da cabaza (CmPS-1)[199] e do cogombro.[200][201] Aínda que se observou unha corelación inversa entre a regulación á alza da expresión de CmPS-1 e a supervivencia de áfidos, os experimentos de alimentación in vitro revelaron que a CmPS-1 recombinante non parecía afectar a supervivencia dos insectos.[199]
Propuxéronse funcións alternativas e dianas de proteases para as serpinas de plantas. A serpina de Arabidopsis, AtSerpin1 (At1g47710; 3LE2), é mediadora dun axuste do control sobre a morte celular programada ao afectar a cisteína protease similar á papaína chamada 'Responsive to Desiccation-21' (RD21).[54][202] A AtSerpin1 tamén inhibe as proteases similares á metacaspase in vitro.[53] Outras dúas serpinas de Arabidopsis, AtSRP2 (At2g14540) e AtSRP3 (At1g64030) parecen estar implicadas en respostas a danos no ADN.[203]
Fúnxicas
Caracterizouse unha soa serpina fúnxica ata agora: a celpina do fungo Piromyces spp. cepa E2. Piromyces é un xénero de fungos anaerobios que se atopan no rume de ruminantes e é importante para dixerir material vexetal. Predise que a celpina é inhibitoria e contén dous dominios de dockerina N-terminais ademais do seu dominio de serpina. As dockerinas atópanse comunmente en proteínas que se localizan no celulosoma fúnxico, un gran complexo multiproteico extracelular que degrada a celulosa.[38] En consecuencia, suxeriuse que a celpina pode protexer o celulosoma contra as proteases das plantas. Certas serpinas bacterianas localízanse igualmente no celulosoma.[204]
Procariotas
Os xenes de serpinas preditos están distribuídos esporadicamente en procariotas. Os estudos in vitro sobre algunhas destas moléculas revelaron que poden inhibir as proteases, e sinalouse que funcionan como inhibidores in vivo. Varias serpinas procariotas atópanse en extremófilos. Polo tanto, e a diferenza das serpinas de mamíferos, estas moléculas posúen unha elevada resistencia á desnaturalización por calor.[205][206] O papel preciso da maioría das serpinas bacterianas segue sen estar claro, aínda que a serpina de Clostridium thermocellum localízase no celulosoma. Suxeriuse que o papel das serpinas asociadas ao celulosoma pode ser impedir a actividade de proteases non desexada contra o celulosoma.[204]
Virais
Os virus tamén expresan serpinas como unha maneira de evadirse da defensa inmunitaria do hóspede.[207] As serpinas expresadas por Poxviridae, como o o virus da varíola das vacas (vaccinia) e da varíola do coello (mixoma), son interesantes debido ao seu potencial uso como novas terapéuticas para os trastornos inmunes e inflamatorios e na terapia de transplantes.[208][209] A Serp1 suprime a resposta inmune innata mediada por TLR e permite unha supervivencia indefinida de aloenxertos en ratas.[208][210] a Crma e a Serp2 son inhibidores de clase cruzada e a súa diana son serina proteases (grancima B; aínda que feblemente) e cisteína proteases (caspase 1 e caspase 8).[211][212] En comparación cos seus equivalentes en mamíferos, as serpinas virais conteñen delecións significativas de elementos de estrutura secundaria. Especificamente, o crmA carece de hélice D así como de porcións significativas das hélices A e E.[213]
Notas
Véxase tamén
Ligazóns externas
- Merops protease inhibitor claudication (Family I4) Arquivado 8 de decembro de 2016 en Wayback Machine.
- Serpins Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- James Whisstock laboratory na Universidade de Monash
- Jim Huntington laboratory Arquivado 30 de outubro de 2016 en Wayback Machine. na Universidade de Cambridge
- Frank Church laboratory na Universidade de Carolina do Norte en Chapel Hill
- Paul Declerck laboratory na Universidade Católica de Lovaina
- Tom Roberts laboratory na Universidade de Sidnei
- Robert Fluhr laboratory no Weizmann Institute of Science
- Peter Gettins laboratory na Universidade de Illinois en Chicago
- Relación de toda a información estrutural dispoñible en PDB para UniProt: P01009 (Human Alpha-1-antitrypsin) en PDBe-KB.