Иридиум
Иридиум — хемиски елемент откриен во 1803 година меѓу нерастворливи нечистотии во природна платина. Смитсон Тенант, примарен пронаоѓач, го нарекува иридиумот по грчката божица Ирида, олицетворение на виножитото, поради впечатливите и разновидни бои на неговите соли. Иридиум е еден од најретките елементи во Земјината кора, со годишно производство и потрошувачка од само три тони. 191Ir и 193Ir се единствените два природни изотопи на иридиум, како и единствените стабилни изотопи; вториот е повеќе изобилен од двете.
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Општи својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име и симбол | иридиум (Ir) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | сребрено-бела | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Иридиумот во периодниот систем | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број | 77 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандардна атомска тежина (±) (Ar) | 192,217(3)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | преоден метал | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група и блок | група 9, d-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периода | VI периода | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронска конфигурација | [Xe] 4f14 5d7 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
по обвивка | 2, 8, 18, 32, 15, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физички својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза | цврста | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на топење | 2.719 K (2.446 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на вриење | 4.403 K (4.130 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина близу с.т. | 22,56 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| кога е течен, при т.т. | 19 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на топење | 41,12 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на испарување | 564 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Моларен топлински капацитет | 25,10 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
парен притисок
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксидациони степени | −3, −1, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | Полингова скала: 2,20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Енергии на јонизација | I: 880 kJ/mol II: 1.600 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски полупречник | емпириски: 136 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентен полупречник | 141±6 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Разни податоци | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | страноцентрирана коцкеста (сцк) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Брзина на звукот тенка прачка | 4.825 м/с (при 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинско ширење | 6,4 µм/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинска спроводливост | 147 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електрична отпорност | 47,1 nΩ·m (при 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетно подредување | парамагнетно[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на растегливост | 528 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на смолкнување | 210 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на збивливост | 320 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поасонов сооднос | 0,26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мосова тврдост | 6,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Викерсова тврдост | 1.760–2.200 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бринелова тврдост | 1.670 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-број | 7439-88-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откривање и првото издвојување | Смитсон Тенант (1803) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Најстабилни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Режимите на распад во загради се предвидени, но сè уште не се забележани | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Најважните соединенија на иридиум во употреба се соли и киселини што се формираат со хлор, иако иридиум, исто така, формира голем број на органометални соединенија кои се користат во индустриската катализа и во истражувањата. Металот иридиум се користи кога е потребна висока отпорност на корозија на високи температури, како кај свеќи со високи перформанси, спојници за прекријализирање на полупроводници на високи температури и електроди за производство на хлор во хлоралкали процесот. Иридиум радиоизотопите се користат во некои радиоизотопски термоелектрични генератори.
Иридиум се наоѓа во метеорити во многу повисоки изобилство отколку во Земјината кора.[4] Поради оваа причина, невообичаено големото изобилство на иридиум во глинениот слој на границата на креда-палеогенот доведоа до хипотезата на Алварез дека влијанието на огромен вонземски објект предизвикало исчезнување на диносаурусите и многу други видови пред 66 милиони години. Слично на тоа, иридиумската аномалија во примероци од Тихиот Океан сугерираше влијанието на Елтанин од околу 2,5 милиони години.
Се смета дека вкупната количина на иридиум на планетата Земја е многу повисока од онаа забележана кај коралните карпи, но како и кај другите метали на платина, високата густина и тенденцијата на иридиум да се поврзуваат со железо предизвикаа повеќето иридиум да се спуштат под кора кога планетата беше млада и сè уште стоеше.
Особености
Физички својства

Член на метали на платина, иридиум е бел, сличен на платина, но со мало жолтеникаво фрлање. Поради својата цврстина, кршливост и многу висока точка на топење, цврстиот иридиум е тешко да се машинира, формира или работи; на тој начин, вообичаено се користи металургија во прав.[5] Тоа е единствениот метал за одржување на добри механички својства во воздухот на температура над 1.600 °C (2.910 °F).[6] Таа има 10-то највисока точка на вриење меѓу сите елементи и станува суперпроводник на температура под 0,14 K.[7]
Модулот на еластичност на Иридиум е втор највисок меѓу металите, кој се надминува само со осмиум.[6] Ова, заедно со модул со високо смолкнување и многу ниска бројка за односот на Поасон (односот на надолжниот на страничниот вирус), укажуваат на високиот степен на вкочанетост и отпорност на деформација, кои ја претставија својата изработка во корисни компоненти, што е голема тешкотија. И покрај овие ограничувања и високата цена на иридиум, се развија голем број апликации каде што механичката сила е суштински фактор во некои од исклучително тешките услови во современата технологија.[6]Измерената густина на иридиум е само малку пониска (за околу 0,12%) од онаа на осмиум, познат како најгустиот метал [8].[9] Се појави некаква двосмисленост во врска со тоа кој од двата елементи е погуст, поради малата големина на разликата во густината и тешкотиите при мерењето на тоа,[10] но, со зголемена точност во факторите што се користат за пресметување на густината на х-зраци кристалографски податоци давале густини од 22,56 g / cm3 за иридиум и 22,59 g / cm3 за осмиум.[11]
Хемиски својства
Иридиум е најкористен метал што е отпорен на корозија:[12] не е нападнат од речиси секоја киселина, царска вода, стопена метали или силикати на високи температури. Меѓутоа, може да биде нападнат од некои стопени соли, како што се натриум цијанид и калиум цијанид [13], како и кислород и халогени (особено флуор) [14] при повисоки температури.[15] Иридиум, исто така, реагира директно со сулфур при атмосферски притисок за да се добие иридиум дисулфид.[16]
Соединенија
| Оксидациони состојби[note 1] | |
|---|---|
| −3 | [Ir(CO)3]3− |
| −1 | [Ir(CO)3(PPh3)]− |
| 0 | Ir4(CO)12 |
| +1 | [Ir(CO)Cl(PPh3)2] |
| +2 | IrCl2 |
| +3 | IrCl3 |
| +4 | IrO2 |
| +5 | Ir4F20 |
| +6 | IrF6 |
| +7 | [(η2 -O2)IrO2]+ |
| +8 | IrO4 |
| +9 | [IrO4]+[2] |
Иридиум формира соединенија во оксидациски состојби помеѓу -3 и +9; најчестите оксидациски состојби се +3 и +4.[5] Добро карактеризирани примери на висока оксидациона состојба со висока 6 е ретка, но вклучуваат IrF6 и два мешани оксиди Sr2MgIrO6 и Sr2CaIrO6.[5][17] Покрај тоа, во 2009 година беше објавено дека иридиум (VIII) оксид (IrO4) беше подготвен во услови на матрица изолација (6 K во Ar) со UV зрачење на комплекс на иридиум-пероксид. Меѓутоа, овој вид не се очекува да биде стабилен како суштинска маса на повисоки температури.[18] Највисоката стапка на оксидација (+9), која е исто така највисока регистрирана за секој елемент, е позната само во еден катјон, IrO +4; таа е позната само како гасни фазни видови и не е познато дека формира какви било соли.[2]
Иридиум диоксид, IrO2, сина црна цврста, е единствениот добро орасен оксид на иридиум.[5] Сесквиоксид, Ir2О3, е опишан како сино-црн прав кој се оксидира до IrO2 од ХНО3.[14] Соодветните дисулфиди, диселениди, сесквисулициди и сесциклиниди се познати, и IrS3, исто така, се познати.[5] Иридиум, исто така, формира иридити со оксидациски состојби +4 и +5, како што се К2IrO3 и KIrO3, кои можат да се подготват од реакцијата на калиум оксид или калиум супероксид со иридиум на високи температури.[19]
Иако нема бинарни хидриди на иридиум,IrxHy се познати, се познати комплекси кои содржат IrH4-5 и IrH3-6, каде што иридиумот има статус на оксидација на +1 и +3, соодветно.[20] Троичниот хидрид Mg6Ir2H11 се верува дека содржи и IrH4-5 и 18-електронскиот IrH5-4 анјон.[21]
Не се познати монохалиди или дихалиди, додека трихалиди, IrX3, се познати по сите халогени.[5] За состојбата на оксидација +4 и погоре, се познати само тетрафлуорид, пентафлуорид и хексафлуорид.[5] Иридиум хексафлуорид, IrF6, е испарлива и високо реактивна жолта цврста, составена од октаедрични молекули. Се распаѓа во вода и се сведува на IrF4, кристална цврста, со иридиум црна.[5] Иридиум пентафлуорид има слични својства, но всушност е тетрамер, Ir4F20, формирана од четири октаедри за споделување на агли.[5] Иридиум метал се раствора во стопена алкално-метални цијаниди за да се произведе Ir(CN)3+6 (хексацианиридат) јон.

Васковиот комплекс hексахлориридна (IV) киселина, H2IrCl6, и неговата амониумска сол се најважните иридиумски соединенија од индустриска перспектива.[22] Тие се вклучени во прочистувањето на иридиум и се користат како претходници за повеќето други иридиумски соединенија, како и за подготовка на анодни премази. На IrCl2-6 јон има интензивна темнокафеава боја, и може лесно да се сведе на светло обоени IrCl3-6 и обратно.[22] Иридиум трихлорид, IrCl3, кој може да се добие во безводна форма од директна оксидација на иридиум во прав со хлор на 650 °C,[22] или во хидрирана форма со растворање на Ir2О3 во хлороводородна киселина, често се користи како почетен материјал за синтеза на други Ir (III) соединенија.[5] Друго соединение кое се користи како почетна материјал е амониум хексахлориридат (III), (NH4)3IrCl6. Иридиум (III) комплекси се дијамагнетски (низок-спин) и обично имаат октаедрична молекуларна геометрија.[5]
Органоидиумските соединенија содржат иридиум-јаглеродни врски, каде што металот обично е во пониски оксидациски состојби. На пример, нултата оксидациона држава е најдена во тетраиридиум додекакарбонил, Ir4(CO)12, кој е најчест и стабилен бинарен карбонил на иридиум.[5] Во ова соединение, секој од иридиум атомите е поврзан со другите три, формирајќи тетраедарски кластер. Некои органометални соединенија Ir(I) се доволно забележливи за да бидат именувани по нивните откритија. Едниот е комплексот на Васка, IrCl (CO) [P(C6H5)3]2, кој има необично својство на врзување за молекулата на кислород, O2.[23] Друг катализатор е Crabtree, хомоген катализатор за реакции на хидрогенизација.[24] Овие соединенија се и квадратни рамни, d8 комплекси, со вкупно 16 валентни електрони, кои ја сочинуваат нивната реактивност.[25]
Органски ЛЕД материјал заснован на иридиум е документиран и се покажа како многу посветлен од ДПА или ППВ, па така може да биде основа за флексибилно осветлување на OLED во иднина.[26]
Изотопи
Иридиум има два природни изотопи, 191Ir и 193Ir, со природни изобилие од 37,3% и 62,7%, соодветно.[27] Најмал 37 радиоизотопи, исто така, се синтетизираат, опфаќајќи масен број од 164 до 202. 192Ir, кој паѓа помеѓу двата стабилни изотопи, е најстабилниот радиоизотоп, со полуживот од 73.827 дена и наоѓа апликација во брахитерапија [28] и во индустриската радиографија, особено за неразрушното тестирање на заварени челици во индустријата за нафта и гас; Иридиум-192 извори биле вклучени во голем број радиолошки несреќи. Три други изотопи имаат полуживот од најмалку еден ден-188Ir, 189Ir и 190Ir.[27] Изотопи со маси под 191 распаѓање со некоја комбинација на β + распаѓање, α распаѓање и (ретка) протонска емисија, со исклучок на 189Ir, која се распаѓа со електронски апсење. Синтетички изотопи потешки од 191 распаѓање со β-распаѓање, иако 192Ir, исто така, има и мала патека на пад на електронски зафати.[27] Сите познати изотопи на иридиум биле откриени помеѓу 1934 и 2008 година, а најновите откритија биле 200-202Ir.[29]
Најмалку 32 метастабилни изомери се одликуваат, опфаќајќи маса од 164 на 197. Најстабиот од овие е 192m2Ir, кој се распаѓа со изомерна транзиција со полуживот од 241 година,[27] што го прави постабилен од било кој синтетички изотопи на иридиум во нивните основни состојби. Најмал стабилен изомер е 190m3Ir со полуживот од само 2 μs.[27] Изотопот 191Ir беше првиот од секој елемент кој требаше да биде прикажан да прикаже ефект на Месбауер. Ова го прави корисно за Месбауер спектроскопијата за истражување во физиката, хемијата, биохемијата, металургијата и минералогијата.[30]
Историја
Платинова група

Откривањето на иридиум е испреплетено со оној на платината и другите метали на платинската група. Мајчин платина што ја користеле древните Етиопјани [31] и од Јужноамериканските култури [32] секогаш содржи мало количество на други метали на платина, вклучувајќи ириум. Платината стигнала во Европа како платина ("сребрена"), откриена во 17 век од страна на шпанските освојувачи во регионот денес познат како оддел на Чоко во Колумбија.[33] Откритието дека овој метал не е легура на познати елементи, туку наместо нов посебен елемент, не се случил до 1748 година.[34]
Откривање
Хемичарите кои го проучувале платинот го растворија во царска вода (мешавина на хлороводородна и азотна киселина) за да создадат растворливи соли. Тие секогаш забележале мала количина на темни, нерастворливи остатоци.[6] Џозеф Луј Пруст сметал дека остатокот е графит. [7] Француските хемичари Виктор Колт-Дескотили, Антоан Франсоа, Comte de Fourcroy и Луј Никола Вакелин исто така го набљудувале црниот остаток во 1803, но не добиле доволно за понатамошни експерименти.[6]
Во 1803 година британскиот научник Смитсон Тенант (1761-1815) ги анализирал нерастворливите остатоци и заклучил дека мора да содржи нов метал. Vauquelin го третирал прав наизменично со алкали и киселини [12] и добил испарлив нов оксид, за кој верувал дека е од овој нов метал - кој го нарекол ptene, од грчкиот збор πτηνός ptēnós, "крилесто".[35][36] Теннант, кој ја искористил многу поголемата количина остаток, го продолжил своето истражување и ги идентификувал двата претходно неоткриени елементи во црниот остаток, иридиум и осмиум.[6][12] Тој доби темноцрвени кристали (веројатно од На2[IrCl6] · nH2O) со низа реакции со натриумхидроксид и хлороводородна киселина.[36] Тој го иритира иридиумот по Ирида (Ἶρις), грчката крилеста божица на виножитото и гласник на олимписките богови, бидејќи многу од солите што ги добил биле силно обоени [note 2][37] Откривањето на новите елементи е документирано во писмо до Кралското друштво на 21 јуни 1804.[6][38]
Металообработка и апликации
Британскиот научник Џон Џорџ Дејт беше прв кој стопи примерок од иридиум во 1813 година со помош на "најголемата галванична батерија што некогаш била изградена" (во тоа време).[6] Првиот кој добил висока чистота на иридиум бил Роберт Харе во 1842 година. Тој открил дека има густина од околу 21,8 g / cm3 и забележал дека металот е речиси неподнослив и многу тежок. Првото топење во значителна количина го направиле Анри Сент-Клер Девил и Жулс Анри Дебре во 1860 година. Тие барале да се запалат повеќе од 300 литри чист О2 и H2 гас за секој килограм иридиум.[6]
Овие екстремни потешкотии во топењето на металот ги ограничуваа можностите за ракување со иридиум. Џон Исак Хокинс се обидуваше да добие парична казна и тврда точка за пенкало, и во 1834 година успеа да создаде златна пенкало со ириум. Во 1880 година, Џон Холандија и Вилијам Лофланд Дадли успеаја да се топат иридиум со додавање на фосфор и патентиран процесот во САД; Британската компанија Џонсон Мети подоцна изјави дека користеле сличен процес од 1837 година и веќе претставиле споен иридиум на голем број светски саеми.[6] Првата употреба на легирање на иридиум со рутениум во термопарови беше направена од Ото Феуснер во 1933 година. Овие услови овозможија мерење на високи температури во воздухот до 2000 °C.[6]
Во Минхен, Германија во 1957 година, Рудолф Месбауер, во она што се нарекува еден од "обележјата експерименти во физиката од дваесеттиот век",[39] откриле резонантна и отпорност на емисија и апсорпција на гама-зраци со атоми во солиден примерок од метал кој содржи само 191Ir.[40] Овој феномен, познат како ефект на Месбауер (којшто оттогаш бил забележан кај други јадра, како што е 57Fe), и развиен како Месбауер спектроскопија, направил важен придонес во истражувањата во физиката, хемијата, биохемијата, металургијата и минералогијата.[30] Месбауер ја доби Нобеловата награда за физика во 1961 година, на 32-годишна возраст, само три години откако го објави своето откритие.[41] Во 1986 година Рудолф Мосбауер беше одликуван за неговите достигнувања со медалот Алберт Ајнштајн и медалот Елиот Кресон.
Појава


Иридиум е еден од деветте најслаби стабилни елементи во Земјината кора, со просечна масена фракција од 0.001 ppm во корална карпа; платина е 10 пати повеќе изобилство, злато е 40 пати повеќе изобилство, а среброто и живата се 80 пати повеќе изобилие.[5] Телурот е исто толку изобилен како иридиум.[5] За разлика од нејзиното мало изобилство во коралниот карпа, иридиумот е релативно чест кај метеоритите, со концентрации од 0,5 ppm или повеќе.[43] Целокупната концентрација на iridium на Земјата се смета дека е многу повисока од онаа што се забележува кај карпите на кора, но поради густината и сидеофиличниот ("сакан") карактер на иридиум, се спушташе под кората и во јадрото на Земјата кога планетата сè уште беше стопена.[22]
Иридиум се наоѓа во природата како некомбиниран елемент или во природни легури; особено на иридиум-осмиумските легури, осмириум (богат со осмиум) и иридосмиум (богат со ириум).[12] Во никел и бакар депозити, метали на платина група се јавуваат како сулфиди (т.е. (Pt, Pd) S), телуриди (т.е. PtBiTe), антимониди (PdSb) и арсениди (т.е. PtAs
2). Во сите овие соединенија платина се разменува со мала количина на иридиум и осмиум. Како и кај сите метали на платина, iridium може да се најде природно во легури со суров никел или суров бакар.[44] Познати се голем број на доминантни минерали од иридиум, со иридиум како елемент кој формира видот. Тие се многу ретки и често ги претставуваат иридиумните аналози на горенаведените. Примерите се ирачки и куроиридин, за да споменам некои.[45][46][47][48][49]
Во внатрешноста на Земјината кора, iridium се наоѓа во највисоки концентрации во три вида геолошка структура: вулкански депозити (корални удари одоздола), кратери за удари и депозити преработени од една од поранешните структури. Најголемите познати примарни резерви се наоѓаат во комплексот на Бушвелд во Јужна Африка,[50] (во близина на најголемиот познат кратер на ударот, кратерот Вредфорт), иако големите депозити од бакар-никел во близина на Нориљск во Русија и во Садберискиот басен кратер) во Канада исто така се значајни извори на иридиум. Помалите резерви се наоѓаат во САД.[50] Иридиум, исто така, се наоѓа во секундарните депозити, во комбинација со платина и други метали на платина во алувијалните депозити. Алувијалните депозити што ги користат претколумболиските луѓе во Одделот за Чоко на Колумбија сè уште се извор на метали на платина. Од 2003 година, светските резерви не се проценети.[12]
Границата на креда-палеогенот

Границата [границата со креда и палеогени] од 66 милиони години, означувајќи ја временската граница помеѓу периодите на креда и палеогенот во геолошко време, беше идентификуван со тенок слој на глината богата со иридиум.[51] Тимот предводен од Луис Алварез предложен во 1980 година е вонземјано потекло за овој иридиум, припишувајќи го на удар на астероид или комета.[51] Нивната теорија, позната како хипотезата на Алварез, сега е широко прифатена да објасни за истребување на не-птичји диносауруси. Голема погребана структура на кратерот на удари со проценета возраст од околу 66 милиони години подоцна беше идентификувана според она што сега е полуостровот Јукатан (кратерот Chicxulub).[52][53] Дјуи М. Меклин и други тврдат дека иридиумот можеби е од вулканско потекло, наместо тоа, бидејќи јадрото на Земјата е богато со иридиум, а активните вулкани како Piton de la Fournaise, на островот Реунион, сè уште ослободуваат иридиум.[54][55]
Производство
| Година | Потрошувачка (тони) | Цена (USD/ozt)[56] |
|---|---|---|
| 2001 | 2,6 | 415,25 |
| 2002 | 2,5 | 294,62 |
| 2003 | 3,3 | 93,02 |
| 2004 | 3,60 | 185,33 |
| 2005 | 3,86 | 169,51 |
| 2006 | 4,08 | 349,45 |
| 2007 | 3,70 | 444,43 |
| 2008 | 3,10 | 448,34 |
| 2009 | 2,52 | 420,4 |
| 2010 | 10,40 | 642,15 |
Иридиум, исто така, се добива комерцијално како нуспроизвод од никел и бакар за обработка и преработка. Во текот на електроразличувањето на бакар и никел, благородните метали како што се среброто, златото и металите на платинската група, како и селенот и телурот, се допираат до дното на ќелијата како анодна кал, што ја формира почетната точка за нивна екстракција. За да ги раздвојат металите, тие прво мора да бидат решени. Неколку методи за одделување се достапни во зависност од природата на мешавината; две претставителни методи се соединување со натриум пероксид проследено со растворање во царска вода и растворање во мешавина од хлор со хлороводородна киселина.[22][50]
Откако смесата се раствора, иридиумот е одделен од другите метали на платина, со преципитација на амониум хексахлориридат ((NH4)2IrCl6) или со екстракција на IrCl2-6 со органски амини.[57] Првиот метод е сличен на постапката Tennant и Wollaston кои се користат за нивно раздвојување. Вториот метод може да се планира како континуирана екстракција на течноста и течноста и затоа е погодна за производство на индустриски обем. Во секој случај, производот се намалува со употреба на водород, давајќи го метал како прашок или сунѓер кој може да се третира користејќи техники на металургија во прав.[58][59]
Цените на иридиум флуктуираа во значителен опсег. Со релативно мал волумен на светскиот пазар (во споредба со други индустриски метали како алуминиум или бакар), цената на иридиумот реагира силно на нестабилноста во производството, побарувачката, шпекулациите, купувањето и политиката во земјите-производители. Како супстанција со ретки својства, нејзината цена е особено под влијание на промените во современата технологија: постепеното намалување помеѓу 2001 и 2003 година е поврзано со преголемото снабдување со IR crucibles кои се користат за индустриски раст на големи монокристали.[56][60]
Исто така цените над 1000USD / oz помеѓу 2010 и 2014 година се објаснети со инсталирање на производствени капацитети за монокристални сафири кои се користат во LED осветлување за телевизори.[61]
Апликации
Побарувачката за иридиум се зголеми од 2,5 тони во 2009 година на 10,4 тони во 2010 година, главно поради апликации поврзани со електроника кои забележаа пораст од 0,2 до 6 тони - иридиумовите садови најчесто се користат за одгледување на големи висококвалитетни монокристали, побарувачка за која значително се зголеми. Ова зголемување на потрошувачката на иридиум се предвидува да се засити поради акумулираните резерви на пресудни моменти, како што се случи во почетокот на 2000-тите. Други главни апликации вклучуваат свеќички кои консумираат 0,78 тони иридиум во 2007 година, електроди за хлоралкали процес (1,1 т во 2007 година) и хемиски катализатори (0,75 т во 2007).[56][62]
Индустриски и медицински
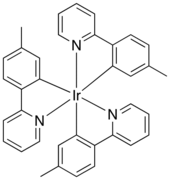
Молекуларна структура на Ir (mppy)3
Високиот степен на топење, тврдост и отпорност на корозија на иридиум и неговите легури ги одредуваат повеќето од неговите апликации. Иридиум (или понекогаш платиумски легури или осмиум) и претежно иридиумски легури имаат ниско ниво на абење и се користат, на пример, за мулти-спојни спојници, преку кои се топи пластичен полимер се екструдира за да формираат влакна, како што се вискоза [63]. Осмиум-иридиум се користи за лежишта на компас и за рамнотежи.[64]
Нивната отпорност на лак-ерозија ги прави иридиумските легури идеални за електрични контакти за свеќички,[65][66] и свеќички засновани на иридиум се користат во воздухопловството.
Чистиот иридиум е исклучително кршлив, до тој степен што тешко може да се завари, бидејќи зоната погодена од топлина е пукнатина, но може да се направи повеќе пластична со додавање на мали количества титаниум и циркониум (0.2% од секој изгледа добро) [67]
Корозијата и отпорноста на топлина го прават иридиумот важен легирање. Одредени делови од моторот со долг животен век се направени од легура на иридиум, а легура на иридиум-титаниум се користи за длабоки водоводни цевки поради неговата отпорност на корозија.[12] Иридиум исто така се користи како стврднувач во легурите на платина. Тврдоста на Викерс чистата платина е 56 HV, додека платината со 50% ириум може да достигне над 500 HV.[68][69]
Уредите кои мора да издржат екстремно високи температури често се направени од иридиум. На пример, во Чехралскиот процес се употребуваат високотемпературни садови од иридиум изработени од иридиум за производство на оксидни монокристали (како што се сафири) за употреба во компјутерски мемориски уреди и во ласери со цврста состојба [65][70] Кристалите, како што се гадолиниум галиум гранат и иттриум галиум гранат, се одгледуваат со топење пред-синтерувани полнења на мешани оксиди под оксидирачки услови на температура до 2100 °C.[6]
Иридиумските соединенија се користат како катализатори во процесот на Cativa за карбонилација на метанол за да се произведе оцетна киселина.[71]
Радиоизотопот иридиум-192 е еден од двата најважни извори на енергија за употреба во индустриската γ-радиографија за недеструктивно тестирање на метали.[72][73] Дополнително, 192Ir се користи како извор на гама-зрачење за третман на рак со брахитерапија, форма на радиотерапија, каде што затворен радиоактивен извор се става во или до областа каде што е потребен третман. Специфични третмани вклучуваат брахитерапија со простата доза, брахитерапија на билијарниот канал и брахиреапија на грлото на матката.[12]
Во февруари 2019 година, медицинските научници објавија дека iridium во прилог на албумин, создавајќи фотосензибилизирана молекула, може да продира во клетките на ракот и, откако ќе биде озрачен со светлина (процес наречен фотодинамичка терапија), ги уништува клетките на ракот.[74][75]
Иридиум е добар катализатор за распаѓање на хидразин (во топол азот и амонијак), и ова се користи во практиката во ракетните мотори со низок притисок; има повеќе детали во написот за монопропуларна ракета.
Научни

Легура од 90% платина и 10% иридиум беше употребена во 1889 година за да се изгради Меѓународниот прототип на метар и килограм маса, што ја води Меѓународното биро за тежини и мерки близу Париз.[12] Металната лента беше заменета како дефиниција на основната единица на должина во 1960 година со линија во атомскиот спектар на криптонот, но килограм прототипот сè уште е меѓународен стандард на маса (до 20 мај 2019 година) [76]
Иридиум се користи во радиоизотопските термоелектрични генератори на беспилотни летала како што се Војаџер, Викинг, Пионер, Касини, Галилео и Новите хоризонти. Иридиум беше избран да го капсулира горивото плутониум-238 во генераторот, бидејќи може да издржи оперативни температури до 2000 °C и за неговата голема сила [6] .
Друга употреба се однесува на рендгенската оптика, особено на телескопите со рентгенски зраци.[77] Огледалата на Опсерваторијата на Хандра на Чандра се обложени со слој од iridium 60 nm дебелина. Иридиум се покажа како најдобар избор за рефлектирање на Х-зраците по никел, злато и платина. Слој на иридиум, кој мораше да биде мазен во рамките на неколку атоми, беше нанесен со депонирање на пареата на иридиум под висок вакуум на основа на слој на хром.[78]
Иридиум се користи во честичната физика за производство на антипротони, форма на антиматерија. Антипротоните се направени со снимање на протонски зрак со висок интензитет при претворање, што треба да се направи од материјал со многу висока густина. Иако волфрам може да се користи наместо тоа, иридиум ја има предноста на подобра стабилност под ударните бранови предизвикани од порастот на температурата поради инцидентни зраци.[79]

Активацијата на јаглерод-водородните врски (C-H активација) е област на истражување на реакции кои ги прицврстуваат јаглерод-водородните врски, кои традиционално се сметаа за нереактивни. Првите пријавени успеси при активирање на C-H врски во заситените јаглеводороди, објавени во 1982 година, користеле органометални иридиумски комплекси кои се подложени на оксидативно додавање со јаглеводородот.[80][81]
Иридиумските комплекси се испитуваат како катализатори за асиметрична хидрогенација. Овие катализатори се користат во синтезата на природни производи и можат да ги хидрогенираат одредени тешки супстрати, како што се нефикнуирани алкени, енантиоселективно (генерирање само еден од двата можни енантиомери).[82][83]
Иридиум формира различни комплекси од фундаментален интерес за триплетна берба [84][85][86]
Историски

Иридиум-осмиумските легури се користеа во совети за фибер пенкало. Првата голема употреба на иридиум била во 1834 година во коцки монтирани на злато.[6] Од 1944 година, познатата ткаена пенкало Parker 51 беше опремена со пиштол од рутениум и легура на иридиум (со 3,8% иридиум). Материјалот на врвот во модерните пенкала за фонтани сè уште е конвенционално наречен "иридиум", иако во него ретко има ириум; други метали како што се рутениум, осмиум и волфрам се заземаат.[87]
Иридиум-платина легура се користи за дупки на допир или пропустливи парчиња топови. Според извештајот на Париската изложба од 1867 година, едно од деловите што ги изложуваат Џонсон и Мети "се употребува во пиштол Withworth за повеќе од 3000 круга и едвај покажува знаци на носење. Оние кои знаат постојана неволја и трошоците кои се предизвикани со носење на вентилаторите на топови кога се активни, ќе ја ценат оваа важна адаптација ".[88]
Пигментниот iridium black, кој се состои од многу ситно поделен iridium, се користи за цртање порцелан интензивна црна боја; беше кажано дека "сите други порцелански црни бои се појавуваат сиви од страна на тоа".[89]
Мерки на претпазливост
Иридиум во обемна метална форма не е биолошки значаен или опасен за здравјето поради недостатокот на реактивност со ткивата; има само околу 20 делови на трилион на иридиум во човечкото ткиво.[12] Како и повеќето метали, ситно поделен иридиумски прав може да биде опасен за ракување, бидејќи е раздразнувач и може да запали во воздух.[50] Многу малку е познато за токсичноста на соединенијата на иридиум, бидејќи тие се користат во многу мали количини, но растворливите соли, како што се иридиум халидите, може да бидат опасни поради други елементи, освен иридиум или поради самиот иридиум.[28] Сепак, повеќето иридиумови соединенија се нерастворливи, што ја отежнува апсорпцијата во телото.[12]
Радиоизотоп на иридиум, 192Ir, е опасно, како и другите радиоактивни изотопи. Единствените пријавени повреди поврзани со иридиум се однесуваат на случајно изложување на зрачење од 192Ir се користи во брахитерапија.[28] Високо енергетско гама-зрачење од 192Ir може да го зголеми ризикот од рак. Надворешната експозиција може да предизвика изгореници, труење со зрачење и смрт. Проголтувањето на 192Ir може да ги изгори облогите на желудникот и цревата [90]. 192Ir, 192mIr и 194mIr имаат тенденција да се депонираат во црниот дроб и можат да претставуваат опасност по здравјето од гама и бета радиоактивност.[43]
Белешки
Наводи
Надворешни врски
- Iridium at The Periodic Table of Videos (University of Nottingham)
- Iridium in Encyclopædia Britannica
Предлошка:Iridium compounds

