ურანი (ელემენტი)
| ურანი |
| 92U |
| 238.03 |
| 5f3 6d1 7s2 |
ურანი[1][2] (ლათ. Uranium; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეშვიდე პერიოდის, ჯგუფგარეშე (ძველი კლასიფიკაციით მესამე ჯგუფის თანაური ქვეჯგუფის, IIIბ) რადიოაქტიური ქიმიური ელემენტი. განეკუთვნება აქტინოიდების ოჯახს. მისი ატომური ნომერია — 92, ატომური მასა — 238.03, tდნ — 1132.2 °C, tდუღ — 4131 °C, სიმკვრივე (-U) — 19.07 გ/სმ3. მოვერცხლისფრო-თეთრი ფერის ლითონი. ბუნებრივი ურანი შედგება სამი იზოტოპის ნარევისაგან: (99.274%; T1/2=4.468×109 წ), (0.720%; T1/2=7.04×108 წ) და (0.005%; T1/2=2.455×105 წ). ხელოვნურად მიღებულია 11 რადიაქტიური იზოტოპი, რომელთა მასური რიცხვებია 227-240. მათ შორის დიდი სიცოცხლის ხანგრძლივობისაა (T1/2=1.592×105 წ), რომელიც მიიღება თორიუმის ნეიტრონული დასხივებით. და რადიოაქტიური მწკრივების დამწყები ელემენტებია.
 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ზოგადი თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | მოვერცხლისფრო ლითონი | |||||||||||||||||||||||||||||||||||||||||||||||||
| სტანდ. ატომური წონა Ar°(U) | 238.02891±0.00003 238.03±0.01 (დამრგვალებული) | |||||||||||||||||||||||||||||||||||||||||||||||||
| ურანი პერიოდულ სისტემაში | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომური ნომერი (Z) | 92 | |||||||||||||||||||||||||||||||||||||||||||||||||
| პერიოდი | 7 პერიოდი | |||||||||||||||||||||||||||||||||||||||||||||||||
| ბლოკი | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | [Rn] 5f3 6d1 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონი გარსზე | 2, 8, 18, 32, 21, 9, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||
ელემენტის ატომის სქემა | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ფიზიკური თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | |||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის ტემპერატურა | 1132.2 °C (1405.3 K, 2070 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||
| დუღილის ტემპერატურა | 4131 °C (4404 K, 7468 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ო.ტ.) | 19.1 გ/სმ3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ლ.წ.) | 17.3 გ/სმ3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის კუთ. სითბო | 9.14 კჯ/მოლი | |||||||||||||||||||||||||||||||||||||||||||||||||
| აორთქ. კუთ. სითბო | 417.1 კჯ/მოლი | |||||||||||||||||||||||||||||||||||||||||||||||||
| მოლური თბოტევადობა | 27.665 ჯ/(მოლი·K) | |||||||||||||||||||||||||||||||||||||||||||||||||
ნაჯერი ორთქლის წნევა
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ჟანგვის ხარისხი | +1, +2, +3, +4, +5, +6 | |||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროდული პოტენციალი | U←U4+ –1.38 ვ U←U3+ –1.66 ვ | |||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 1.38 | |||||||||||||||||||||||||||||||||||||||||||||||||
| იონიზაციის ენერგია |
| |||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის რადიუსი | ემპირიული: 156 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 196±7 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||
| იონური რადიუსი (rion) | (+6e) 80 (+4e) 97 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 186 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||
| მოლური მოცულობა | 12.5 სმ3/მოლი | |||||||||||||||||||||||||||||||||||||||||||||||||
ურანი (ელემენტი)ს სპექტრალური ზოლები | ||||||||||||||||||||||||||||||||||||||||||||||||||
| სხვა თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | |||||||||||||||||||||||||||||||||||||||||||||||||
| მესრის სტრუქტურა | ორთორომბული  | |||||||||||||||||||||||||||||||||||||||||||||||||
| მესრის პერიოდი | 4.955 Å | |||||||||||||||||||||||||||||||||||||||||||||||||
| ბგერის სიჩქარე | 3155 მ/წმ (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||
| თერმული გაფართოება | 13.9 µმ/(მ·K) (25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||
| ხვედრითი თბოტევადობა | 27.67 ჯ/(K·მოლ) | |||||||||||||||||||||||||||||||||||||||||||||||||
| თბოგამტარობა | 27.5 ვტ/(მ·K) | |||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნეტიზმი | პარამაგნეტიკი | |||||||||||||||||||||||||||||||||||||||||||||||||
| იუნგას მოდული | 208 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||
| წანაცვლების მოდული | 111 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||
| დრეკადობის მოდული | 100 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||
| პუასონის კოეფიციენტი | 0.23 | |||||||||||||||||||||||||||||||||||||||||||||||||
| ვიკერსის მეთოდი | 1960–2500 მპა | |||||||||||||||||||||||||||||||||||||||||||||||||
| ბრინელის მეთოდი | 2350–3850 მპა | |||||||||||||||||||||||||||||||||||||||||||||||||
| CAS ნომერი | 7440-61-1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| ისტორია | ||||||||||||||||||||||||||||||||||||||||||||||||||
| სახელწოდება მომდინარეობს | after planet Uranus, itself named after Greek god of the sky Uranus | |||||||||||||||||||||||||||||||||||||||||||||||||
| აღმომჩენია | მარტინ ჰაინრიხ კლაპროთი (1789) | |||||||||||||||||||||||||||||||||||||||||||||||||
| პირველი მიმღებია | ეჟენ პელიგო (1841) | |||||||||||||||||||||||||||||||||||||||||||||||||
| ურანის მთავარი იზოტოპები | ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| • | ||||||||||||||||||||||||||||||||||||||||||||||||||
ისტორია
ჯერ კიდევ ძველი დროიდან (I საუკუნე ჩ.წ.ა-მდე) ურანის ბუნებრივი ჟანგები გამოიყენებოდა კერამიკის ყვითელი მინანქრის დასამზადებლად. ურანის ისტორიის ყველაზე მნიშვნელოვანი პირველი თარიღია — 1789 წელი, როდესაც გერმანელმა ნატურფილოსოფოსმა და ქიმიკოსმა მარტინ ჰენრიხ კლაპროტმა საქსონიის ურანის მადნიდან გამოყოფილი ოქროსფერი-მოყვითალო «მიწა» აღადგინა შავ ლითონისმაგვარ ნივთიერებამდე. იმ დროისათვის ცნობილი ყველაზე შორს მდებარე პლანეტის (8 წლით ადრე აღმოჩენილი უილიამ ჰერშელის მიერ) პატივსაცემად, კლაპროტი მიიჩნევდა რა ახალ ნივთიერებას ქიმიურ ელემენტად, უწოდა მას ურანი (ამით მას სურდა მხარი დაეჭირა იოჰან ელერტ ბოდეს წინადადებისათვის დაერქვათ ახლად აღმოჩენილი პლანეტისათვის ურანი»]], «გეორგის ვარსკვლავის» მაგიერ, როგორც წამოაყენა წინადადება გერშელმა). ორმოცდაათი წელი კლაპროტის ურანი ითვლებოდა ლითონად. მხოლოდ 1841 წ. ფრანგმა ქიმიკოსმა ეჟენ მელკიორ პელიგომ (1811—1890)) დაამტკიცა, რომ ლითონისმაგვარი დამახასიათებელი ბზინვარების მიუხედავად, კლაპროტის ურანი არაა ელემენტი, არამედ არის ურანის 'ოქსიდი UO2. 1840 წ. პელიგომ შეძლო ნამდვილი ურანის მიღება — რომელიც მძიმე რუხი-ფოლადის ფერი ლითონია — და მისი ატომური მასის განსაზღვრა. ურანის შესწავლაში შემდგომი მნიშვნელოვანი ნაბიჯი გააკეთა 1874 წ. დიმიტრი მენდელეევმა. მენდელეევმა მის მიერ შექმნილი პერიოდული სისტების საფუძველზე დაყრდნობით, მან ურანი მოათავსა თავისი ცხრილის ყველაზე შორს მდგომ უჯრაში. ადრე ურანის ატომურ წონა ითვლებოდა 120. უდიდესმა ქიმიკოსმა გააორმაგა ის მნიშვნელობა. 12 წლის შემდეგ მენდელეევის წინასწარმეტყველება დამტკიცებულ იქნა გერმანელი ქიმიკოსის ციმერმანის ცდებით.
1896 წ., ურანის კვლევისას ფრანგმა ქიმიკოსმა ანტუან ბეკერელმა შემთხვევთ აღმოაჩინა ბეკერელის სხივები, რომელსაც მოგვიანებით მარია კიურიმ უწოდა რადიოაქტიურობა. ამ დროისათვის ფრანგმა ქიმიკოსმა ანრი მუასანუმ შეძლო შეემუშავებინა ლითონური სუფთა ურანის მიღების მეთოდი. 1899 წ. რეზერფორდმა აღმოაჩინა, რომ ურანის პრეპარატების გამოსხივება არაერთგვაროვანია, და არის ორი სახის გამოსხივება — ალფა- და ბეტა-სხივები. მათ მიაქვთ სხვადასხვა ელექტრონული მუხტი; მათი გარბენი ნივთიერებაში არ არის ერთნაირი და სხვადასხვაგვარი იონიზირების თვისება აქვთ. ცოტა გვიან, 1900 წ. მაისში პოლ ვიიარმა აღმოაჩინა გამოსხივების მესამე სახეობა — გამა-სხივებით.
ერნესტ რეზერფორდმა 1907 წელს ჩაატარა პირველი ცდები მინერალების წლოვანების განსასაზღვრავად, რადიოაქტიური ურანისა და თორიუმის შესწავლისას მისი და ფრედერიკ სოდისთან (Soddy, Frederick, 1877—1956; ნობელის პრემია ქიმიაში, 1921) ერთად შექმნილი რადიოაქტიურობის თეორიის საფუძველზე. 1913 წელს ფ. სოდიმ შემოიღო იზოტოპების გაგება ( ძვ. ბერძნ. ἴσος — «ტოლი», «ერთნაირი», და τόπος — «ადგილი»), ხოლო 1920 წელს იწინასწარმეტყველა, რომ იზოტოპები შეიძლება გამოყებულ იქნას მთის ქანების გეოლოგიური წლოვანების განსაზღვრისათვის. 1928 წ. ნიგოტმა გაუკეთა რეალიზება, ხოლო 1939 წ. ა. ო. კ. ნირმა (Nier, Alfred Otto Carl, 1911—1994) შექმნა პირველი განტოლება წლოვანების გამოსათვლელად და გამოიყენა მას-სპექტრომეტრი იზოტოპების განსაცალკევებლად.

1938 წ. გერმანელმა ფიზიკოსებმა ოტო ჰანმა და ფრიც შტრასმანმა აღმოაჩინეს უჩვეულო მოვლენა, რაც ურანის ბირთვს ემართება დასხივებისას მისი ნეიტრონებით. იზოტოპ 235U-ის ბირთვის მიერ თავისუფალი ნეიტრონის მიტაცებით ის იყოფა, და ამასთან გამოიყოფა (ურანის ერთ ბირთვზე გათვლით) საკმაოდ დიდი ენერგია, ძირითადად, გამოსხივებისა და ფრაგმენტების კინეტიკური ენერგიის ხარჯზე. მოგვიანებით ამ მოვლენის თეორია დამტკიცებულ იქნა ლიზა მეიტნერის და ოტო რობერტ ფრიშის მიერ. ეს აღმოჩენა იქცა შიდა ატომური ენერგიის როგორც მშვიდობიანი ისე სამხედრო გამოყენების დასაბამად.
1939—1940 წწ. იული ხარიტონმა და იაკობ ზელდოვიჩმა პირველად თეორიულად აჩვენეს, რომ ბუნებრივი ურანის მცირედ გამდიდრებით ურან-235-ით შეიძლება შეიქმნას ატომების ბირთვების უწყვეტი დაყოფის პირობა, ანუ პროცესს ეძლევა ჯაჭვური რეაქციის ხასიათი.
ბუნებაში

ურანი ფართოდაა გავრცელებული ბუნებაში. ურანის კლარკი შეადგენს 0,0003 % (წონ.), ზღვის წყალში მისი კონცენტრაცია შეადგენს 3 მკგ/ლ. ლითოსფეროსს 20 კმ-იან ფენაში ურანის რაოდენობა ფასდება სადღაც 1,3×1014 ტ.
ურანის ძირითადი მასა მდებარეობს მჟავე ქანებში სადაც სილიციუმის დიდი შემცველობაა. ურანის მნიშვნელოვანი მასა კონცენტრირებულია დანალექ ქანებში, განსაკუთრებით კი ორგანიკით მდიდარ ქანებში. ურანი როგორც მინარევი დიდი რაოდენობითაა თორიუმის და იშვიათმიწა მინერალების (ორტიტი, სფენი CaTiO3[SiO4], მონაციტი (La,Ce)PO4, ცირკონი ZrSiO4, ქსენოტიმი YPO4 და სხვა). მნიშვნელოვან ურანის მადნებს წარმოადგენენ ნასტურანი (ურანინიტი) და კანოტიტი. ძირითადი მინერალებია — ურანის თანამგზავრებია მოლიბდენიტი MoS2, გალენიტი PbS, კვარცი SiO2, კალციტი CaCO3, ჰიდრომუსკოვიტი და სხვა.
ლითოსფეროს 20 კმ-იან ფენაში არის ~ 1014 ტ ურანი, ზღვის წყალში 109—1010 ტ.მსოფლიოში ურანის მარაგით, სარეზერვო საბადოების ჩათვლებით, პირველ ადგლზეა ავსტრალია, მეორეზე ყაზახეთი და მესამეზე რუსეთი.
| მინერალი | მინერალის ძირითადი შემადგენლობა | ურანის შემადგენლობა, % |
|---|---|---|
| ურანინიტი | UO2, UO3 + ThO2, CeO2 | 65-74 |
| კარნოტიტი | K2(UO2)2(VO4)2·2H2O | ~50 |
| კაზოლიტი | PbO2·UO3·SiO2·H2O | ~40 |
| სამარსკიტი | (Y, Er, Ce, U, Ca, Fe, Pb, Th)·(Nb, Ta, Ti, Sn)2O6 | 3.15-14 |
| ბრანერიტი | (U, Ca, Fe, Y, Th)3Ti5O15 | 40 |
| ტიუამუნიტი | CaO·2UO3·V2O5·nH2O | 50-60 |
| ცეინერიტი | Cu(UO2)2(AsO4)2·nH2O | 50-53 |
| ოტენიტი | Ca(UO2)2(PO4)2·nH2O | ~50 |
| შრეკინგერიტი | Ca3NaUO2(CO3)3SO4(OH)·9H2O | 25 |
| ურანოფანი | CaO·UO2·2SiO2·6H2O | ~57 |
| ფერგუსონიტი | (Y, Ce)(Fe, U)(Nb, Ta)O4 | 0.2-8 |
| ტორბერნიტი | Cu(UO2)2(PO4)2·nH2O | ~50 |
| კოფინიტი | U(SiO4)(OH)4 | ~50 |
ურანის ძირითად ფორმებს ბუნებაში წარმოადგენენ ურანიტი, ნასტურანი და ურანის შავი. ისინი მხოლოდ არსებობის ფორმით განსხვავდებიან; არსებობს ასაკობრივი დამოკიდებულება: ურანიტიტი არის უმეტესად უძველეს (დოკემბრიულ ქანებში), ნასტურანი — ვულკანოგენურ და ჰიდროთერმალურ — უპირატესად პალეოზოურ და უფრო ახალგაზრდა მაღალ- და საშუალოტემპერატურულ წარმოანქმნებში; ურანის შავი — ძირითადად ახალგაზრდა — კაინოზოურ და უფრო ახალგაზრდა წარმონაქმნებში — უმეტესწილად დაბალტემპერატურულ დანალექ ქანებში.
საბადოები
დედამიწის ქერქში ურანის შემცველობა შეადგენს 0,0003 %, ის გვხვდება მიწის ზედა ფენაში ოთხი სახესხვაობით. უპირველესად, ეს არის ურანიტეტის ძარღვები, ან ურანის დიოქსიდი (UO2), რომელიც მდიდარია ურანით, მაგრამ გვხვდება უფრო იშვიათად. მას თან ახლავს რადიუმი, რადგანაც რადიუმი წარმოადგენს ურანის იზოტოპების დაშლის პირდაპირ პროდუქტს. ასეთი ძარღვები გვხვდება კონგოში, კანადაში (დიდი დათვის ტბა), ჩეხეთში და საფრანგეთში. ურანის მეორე წყაროს წარმოადგენს თორიუმისა და ურანის მადნების კონგლომერატები სხვა მნიშვნელოვან მინერალებთან ერთად. კონგლომერატები ჩვეულებრივ შეიცავენ მოსაპოვებლად საკმაო რაოდენობის ოქროს და ვერცხლს, ხოლო თანდაყოლილ ელემენტებად ურანი და თორიუმი ხდებიან. ამ მადნების დიდი საბადოებია კანადაში, სარ-ში რუსეთში და ავსტრალიაში. ურანის მესამე წყაროს წარმოადგენს დანალექი ქანები და ქვიშაქვები, რომლებიც მდიდარია კარნოტიტის მინერალებით (ურანილ-კალიუმის ვანადატი), რომელიც ურანის გარდა შეიცავს მნიშვნელოვანი რაოდენობის ვანადიუმს და სხვა ელემენტებს. ასეთი მადნები გვხვდება აშშ-ის დასავლეთ შტატებში. რკინაურანის ფიქალები და ფოსფატების მადნები შეადგენენ ურანის მეოთხე წყაროს. ასეთი მდიდარი წარმონაქმნები აღმოჩენილია შვედეთის თიხნარ ფიქალებში. მაროკოსა და აშშ-ის ზოგიერთი ფოსფატური მადანი შეიცავს ურანის მნიშვნელოვან რაოდენობას, ფოსფატური საბადოები ანგოლაში და ცენტრალურ აფრიკის რესპუბლიკაში უფრო მდიდარია ურანით.[3].
იზოტოპები
ურანის ზოგიერთი იზოტოპის რადიოაქტიური თვისებები (გამოყოფილია ბუნებრივი იზოტოპები):
| მასური რიცხვი | ნახევარდაშლის პერიოდი | დაშლის ძირითადი ტიპები |
|---|---|---|
| 233 | 1,59×105 წელი | α |
| 234 | 2,45×105 წელი | α |
| 235 | 7,13×108 წელი | α |
| 236 | 2,39×107 წელი | α |
| 237 | 6,75 დღე-ღამე. | β− |
| 238 | 4,47×109 წელი | α |
| 239 | 23,54 წთ. | β− |
| 240 | 14 სთ. | β− |
ბუნებრივი ურანი შედგება სამი იზოტოპის 238U (იზოტოპიური გავრცობადობა 99,2745 %, ნახევარდაშლის პერიოდი T1/2 = 4,468×109 წელი), 235U (0,7200 %, T1/2 = 7,04×108 წელი) და 234U (0,0055 %, T1/2 = 2,455×105 წელი) ნარევისაგან. ბოლო იზოტოპი წარმოადგენს არა პირველად არამედ რადიოგენურ იზოტოპს, ის შედის ურანის მადნებში 238U-ის რადიოაქტიურ რიგში.
ბუნებრივი ურანის რადიოაქტიურობა განპირობებულია ძირითადი 238U იზოტოპითა და შვილობილი 234U ნუკლიდებით. წონასწორობაში მათი კუთრი აქტიურობა ერთმანეთის ტოლია. იზოტოპ 235U-ის კუთრი აქტიურობა ბუნებრივ ურანში 21-ჯერ ნაკლებია ვიდრე 238U-ის აქტივობა.
დღეისთვის ცნობილია 23 ხელოვნური რადიოაქტიური ურანის იზოტოპი რომლის მასური რიცხვია 217-დან 242-მდე. მათ შორის ყველაზე მნიშვნელოვანია — 233U (T1/2 = 1,59×105წელი) მიიღება თორიუმ-232-ის ნეიტრონებით დასხივებით და შეუძლია სითბური ნეიტრონების ზემოქმედებით ბირთვის დაშლა, რაც მას ხდის ბირთვული რეაქტორების პერსპექტიულ საწვავად. ურანის ყველაზე ხანგრძლივად მცხოვრებ იზოტოპს რომელიც ბუნებაში გვხვდება წარმოადგენს 236U ნახევარდაშლის პერიოდით 2,39×107 წელი.
ურანის 238U და 235U იზოტოპები წარმოადგენენ ორი რადიოაქტიური რიგის საფუძველს. ამ რიგების ბოლო ელემენტები არიან ტყვიის 206Pb და 207Pb იზოტოპები.
ბუნებრივ პირობებში ძირითადად გავრცელებულია 234U, 235U და 238U იზოტოპები შემდეგი შეფარდებითი შემცველობით 234U : 235U : 238U = 0,0054 : 0,711 : 99,283. ბუნებრივი ურანის თითქმის ნახევარი რადიოაქტიურობა განპირობებულია იზოტოპით 234U, რომელიც როგორც აღნიშნულია, წარმოიქმნება 238U-ის დაშლით. შემცველობის შეფარდებას 235U : 238U სხვა იზოტოპების წყვილებთან განსხვავებით და ურანის მაღალ მიგრაციულობის მიუხედავად ახასიათებს გეოგრაფიული მუდმივობა: 235U/238U = 137,88. ამ შეფარდების სიდიდე ბუნებრივ წარმონაქმნებში არაა დამოკიდებული მათ ხნოვანებასთან. ურანშემცველ მინერალებში (ნასტურანი, ცირტოლიტი, იშვიათმიწა მადნები) ამ თანაფარდობის სიდიდე მერყეობს 137,30 — 138,51 შორის; ამასთან UIV და UVI ფორმებს შორის განსხვავება არაა დადგენილი[4]; სფენში — 138,4[5]. ზოგიერთ მეტეორიტებში გამოვლენილია იზოტოპ 235U-ის ნაკლებობა. მისი უმცირესი კონცენტრაცია დედამიწის პირობებში ნაპოვნია 1972 წ. ფრანგი მკვლევარის ბუჟიგესის მიერ ოკლოში აფრიკაში (საბადო გაბონში). ასე რომ, ბუნებრივ ურანში არის 0,720 % ურანი 235U, ეს როცა ოკლოში ის მცირდება 0,557 %-მდე[6]. ეს იყო იმ ჰიპოთთეზის დამტკიცება რომ არსებობს ბუნებრივი ბირთვული რეაქტორი ოკლოში, რომელიც გახდა იზოტოპ 235U-ის გამოწვის მიზეზი. ასეთი ჰიპოთეზა წამოაყენა ჯორჯ ვეტერილმა (George W. Wetherill) კალიფორნიის უნივერსიტეტიდან ლოს-ანჯელესში, მარკ ინგრემმა (Mark G. Inghram) ჩიკაგოს უნივერსიტეტიდან და პოლ კუროდამ (Paul K. Kuroda), არკანზასის უნივერსიტეტიდან, რომლებმაც ჯერ კიდევ 1956 წ. აღწერეს პროცესი[7]. დარდა ამისა, ამ რაიონებში ნაპოვნია ბუნებრივი ბირთვული რეაქტორები: ოკელობონდო, ბანგომბე (Bangombe) და სხვა. დღეს ცნობილია 17 ბუნებრივი ბირთვული რეაქტორი.
მიღება
ურანის წარმოების პირველი სტადიაა — კონცენტრირება. მადნის ქანებს აქუცმაცებენ და ურევენ წყალში. მძიმე ნაწილაკები უფრო მალე ულექება ძირში. თუკი ქანები შეიცავენ ურანის პირველად მინერალებს, მაშინ ისინი ილექებიან უფრო ჩქარა: ესენი არის მძიმე მინერალები. ურანის მეორადი მინერალები უფრო მჩატეებია, ამ შემთხვევაში ადრე ილექება ცარიელი მძიმე ქანი. (თუმცა ეს ქანები ცარიელი არა ყოველთვის; მასში შეიძლება ბევრი სასარგებლო ელემენტი იყოს, მათ შორის ურანიც).
შემდეგი სტადიაა — კონცენტრატების ტუტირება (გამოტუტება), ურანის გადაყვანა ხსნარებში. გამოიყენებენ მჟავა და ტუტე გამოტუტებას. პირველი უფრო იაფია, რადგანაც ურანის გამოსაყოფად გამოიყენებენ გოგირდმჟავას. მაგრამ, თუ საწყის ნედლეულში, მაგალითად ნასტურანში, ურანი ოთხვალენტიანია, მაშინ ეს მეთოდი არ გამოიყენება: ოთხვალენტიანი ურანი გოგირდმჟავაში პრაქტიკულად არ იხსნება. ამ შემთხვევაში საჭიროა ან ტუტით ტუტირება ან ურანის ჯერ დაჟანგვაა სჭირო ექვსვალენტიან მდგომარეობამდე.
მჟავით გამოტუტება არ გამოიყენება იმ შემთხვევაშიც, თუ ურანის კონცენტრატი შეიცავს დოლომიტს ან მაგნეზიტს, რომლებიც რეაგირებენ გოგირდმჟავასთან. ამ შემთხვევაში გამოიყენებენ ნატრიუმს (ნატრიუმის ჰიდროქსიდი).
ურანის გამოტუტების პრობლემას მადნებიდან წყვეტენ ჟანგბადის ჩაბერვით. ურანის სულფიდის მინერალებიან მადანში (რომელიც გაცხელებულია 150 °C-მდე) ჩაბერავენ და მიაწოდებენ ჟანგბადის ჭავლს. ამასთან გოგირდიან მინერალებიდან წარმოიქმნება გოგირდმჟავა, რომელიც შემდეგ გამორეცხავს ურანს.
შემდგომ ეტაპზე მიღებული ხსნარიდან გამორჩევით უნდა გამოიყოს ურანი. თანამედროვე მეთოდები — ექსტრაქცია და იონური მიმოცვლა — ხსნიან ამ პრობლემას.
ხსნარი შეიცავს არა მარტო ურანს, არამედ სხვა კათიონებს. ზოგიერთი მათგანი განსაზღვრულ პირობებში იქცევიან ისევე როგორც ურანი: ექსტრაგირდებიან იგივე ორგანული ნაერთებით გამხსნელებით, ჯდებიან იგივე იონმიმომცვლელებზე, ილექებიან იგივე პირობებში. ამიტომაც ურანის სელექტური გამყოფისათვის საჭიროა მრავალი ჟანგვა-აღდგენითი რეაქცია, რათა ყოველ სტადიაზე მოვაცილოთ არასასურველი თანამგზავრი.
იონური მიმოცვლის და ექსტრაქციის" მეთოდები კარგია იმითაც, რომ იძლევა საშუალებას საკმაოდ სრულად გამოყოს ურანი, ღარიბი ხსნარებიდან (ურანის შემცველობა — გრამის მეათედი წილია ლიტრზე).
ამ ოპერაციის შემდეგ ურანი გადაჰყავთ მყარ მდგომარეობაში — ერთ-ერთ ოქსიდად ან ტეტრაფტორიდად UF4. მაგრამ ეს ურანი ჯერ კიდევ გასაწმენდია მინარევებისაგან — ბორის, კადმიუმის ჰაფნიუმის სითბური ნეიტრონებისაგან. მათი შემცველობა ბოლო პროდუქტში არ უნდა აღემატებოდეს პროცენტის ასიათას და მემილიონედ წილს. ამ მინარევების მოსაცილებლად ტექნიკურად სუფთა ურანის ნაერთებს ხსნიან აზოტმჟავაში. ამასთან წარმოიქმნება ურანილნიტრატი UO2(NO3)2, რომელიც ტრიბუტილ-ფოსფატით და სხვა ნივთიერებებით ექსტრაქციისას დამატებით იწმინდება საჭირო კონდიციამდე. შემდგომ ამ ნივთიერებას აკრისტალებენ და ფრთხილად ახურებენ. ამ ოპერაციის შედეგად წარმოიქმნება ურანის ოქსიდი UO3, რომელსაც აღადგენენ წყალბადით UO2-მდე.
ურანის დიოქსიდზე UO2 430-დან 600 °C-მდე ტემპერატურისას ზემოქმედებენ აიროვან ფტორწყალბადს ტეტრაფტორიდის UF4 მისაღებად. ამ ნაერთიდან აღადგენენ ლითონურ ურანს კალციუმისა ან მაგნიუმის დახმარებით.
ფიზიკური თვისებები
ურანი — ძალიან მძიმე, მოვერცხლისფრო-თეთრი ფერის პრიალა ლითონია. სუფთა სახით ის ცოტათი ურო რბილია ვიდრე ფოლადი, არის ჭედადი, დრეკადი, აქვს ცოტათი პარამაგნეტიკური თვისებები.ურანს აქვს სამი კრისტალური მოდიფიკაცია:
(სტაბილურია 667,7 °C-მდე), რომბული სინგონია, C mcm' სივრცული ჯგუფი', უჯრედის პარამეტრებია a = 0,2858 ნმ, b = 0,5877 ნმ, c = 0,4955 ნმ, Z = 4;
(სტაბილურია 667,7 °C-დან 774,8 °C-მდე), ტეტრაგონალური სინგონია, P 4თარგი:Sub/mnm სივრცული ჯგუფი, უჯრედის პარამეტრბია a = 1,0759 ნმ, c = 0,5656 ნმ, Z = 30;
(არსებობს 774,8 °C-დან დნობის წერტილამდე), კუბური სინგონია, I m3m' სივრცული ჯგუფი, უჯრედის პარამეტრებია a = ,3524 ნმ, Z = 2.
ქიმიური თვისებები[8][9]
დამახასიათებელი დაჟანგვის ხარისხები
ურანი შეიძლება ავლენდეს დაჟანგვის შემდეგი ხარისხები +3-დან +6-მდე.
| დაჟანგვის ხარისხი | ოქსიდი | ჰიდროქსიდი | დახასიათება | ფორმა | შენიშვნა |
|---|---|---|---|---|---|
| +3 | არ არსებობს | არ არსებობს | -- | U3+, UH3 | ძლიერი აღმდგენელი |
| +4 | UO2 | არ არსებობს | ფუძე | UO2, ჰალოგენიდები | |
| +5 | არ არსებობს | არ არსებობს | -- | ჰალოგენიდები | წყალში დისპროპორცირდება |
| +6 | UO3 | UO2(OH)2 | ამფოტერული | UO22+ (ურანილი) UO42- (ურანატი) U2O72- (დიურანატი) | მდგრადია წყალზე და ჰაერზე |
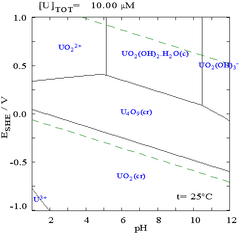
ამას გარდა, არსებობს ოქსიდი U3O8. მასში დაჟანგვის ხარისხი ფორმალურად დაყოფილია, ხოლო რეალურად წარმოადგენს შერეული ოქსიდები (V) და (VI).
ადვილად შესამჩნევია, რომ დაჟანგვის ხარისხით და დამახასიათებელი ნაერთებით ურანი ახლოსაა VIB ქვეჯგუფის ელემენტებთან (ქრომთან, მოლიბდენთან, ვოლფრამთან). ამის გამო მას დიდი ხნის განმავლობაში მიაკუთვნებდნენ ამ ქვეჯგუფს.
მარტივი ნივთიერების თვისებები
ქიმიურად ურანი მეტად აქტიურია. ის სწრაფად იჟანგება ჰაერზე და იფარება ოქსიდის თხელი აპკით. ურანის მწვრილი ფხვნილი ჰაერზე თვითაალდება, ის აალდება 150—175 °C ტემპერატურისას, და წარმოქმნის U3O8. ლითონური ურანის რეაქცია სხვა ლითონებთან ცხრილშია მოყვანილი.
| არალითონი | პირობები | პროდუქტი |
|---|---|---|
| F2 | 20oC, აქტიურად | UF6 |
| Cl2 | 180oC დაქუცმაცებულისათვის 500—600oC კომპაქტურისათვის | ნარევი UCl4, UCl5, UCl6 |
| Br2 | 650oC, მშვიდად | UBr4 |
| I2 | 350oC, მშვიდად | UI3, UI4 |
| S | 250-300oC მშვიდად 500oC იწვის | US2, U2S3 |
| Se | 250-300oC მშვიდად 500oC იწვის | USe2, U2Se3 |
| N2 | 450-700oC წნევის ქვეშ N 1300o | UN1.75 UN2 UN |
| P | 600-1000oC | U3P4 |
| C | 800-1200oC | UC, UC2 |
წყალს შეუძლია შეჭამოს (კოროზია) ლითონი, დაბალ ტემპერატურაზე მიდის ნელა, და სწრაფად მაღალი ტემპერატურისას, და ასევე ურანის მწვრილ ფქვნილზე:
არა დამჟანგავ მჟავეებში ურანი იხსნება და წარმოქმნის UO2 ან მარილს U4+ (ამ დროს წარმოიქმნება წყალბადი). მჟანგავ მჟავეებში (აზოტის, კონცენტრირებულ გოგირდმჟავას) ურანი წარმოქმნის შესაბამის მარილებს ურანილებს UO22+
ტუტეების ხსნარებთან ურანი არ ურთიერთქმედებს.
ძლიერი დაფერთხვისას ურანის ლითონური ნაწილაკები იწყებენ ნათებას.
ურანის ნაერთები III
ურანის მარილები(+3) (უპირატესად, ჰალოგენიდები) — აღმდგენელები. ჰაერზე ოთახის ტემპერატურაზე ისინი ჩვეულებრივ მდგრადები არიან, თუმცა გახურებისას იჟანგება პროდუქტების ნარევამდე. ქლორი ჟანგავს UCl4-მდეწარმოქმნის არამდგრად წითელი ფერის ხსნარებს, რომლებშიც ავლენენ ძლიერ აღმდგენელ თვისებებს:
ურან III ჰალოგენიდები წარმოიქმნებიან ურან (IV) ჰალოგენიდების წყალბადით აღდგენით :
(550—590оC)
ან იოდწყალბადით:
(500оC)
ასევე ჰალოგენიდების ქმედებით ურანის ჰიდრიდზე UH3.
ამას გარდა, არსებობს ურანის ჰიდრიდი (III) UH3. ის შეიძლება მივიღოთ, ურანის ფხვნილის გახურებით წყალბადში 225оС ტემპერატურამდე, ხოლო ზევით 350оС ტემპერატურისას ის იშლება. მისი რეაქციის უმეტესი ნაწილი (მაგალითად, წყლის ორთქლსა და მჟავეებთან) შეიძლება ფორმალურად განიხილოს როგორც თანმიმდევრობითი ჯერ დაშლის რეაქცია შემდგომ კი ლითონური ურანთან რეაქცია:
ურან IV ნაერთები
ურან (+4) წარმოქმნის წყალში ადვილად ხსნად მწვანე ფერის მარილებს. ისინი ადვილად იჟანგებიან ურან (+6)-მდე
ურან V-ის ნაერთები
ურან (+5) ნაერთები არამდგრადები არიან და ადვილად დისპროპორცირდებიან წყლის ხსნარში:
ურან V ქლორიდი ნაწილობრივ დისპროპორცირდება:
ნაწილობრივ კი აცლის ქლორს:
ურან VI-ის ნაერთები
+6 დაჟანგვის ხარისხს შეესაბამება ოქსიდი UO3. მჟავეებში ის იხსნება ურანილის კათიონის წარმოქმნით UO22+:
ფუძეებთან UO3 ( CrO3, MoO3 და WO3 ანალოგიურად) წარმოქმნის სხვადასხვა ურანატ-ანიონებს (უპირველეს ყოვლისა, დიურანატს U2O72-). თუმცა ბოლო, ხშირად მიიღებენ ფუძისა და ურანილის მარილის ურთიერთქმედებით:
ურანის (+6) ნაერთებიდან, სადაც არ არის ჟანგბადი, ცნობილია მხოლოდ ჰექსაქლორიდი UCl6 და ფტორიდი UF6. ბოლო თამაშობს მნიშვნელოვან როლს ურანის იზოტოპის დაყოფაში.
ურან (+6) ნაერთები უფრო მდგრადებია ჰაერზე და წყლის ხსნარებში.
ურანილებიანი მარილები, როგორიცაა ურანილქლორიდი, იშლებიან კაშკაშა სინათლეზე ან ორგანული ნაერთების არსებობისას.
ურანი ასევე წარმოქმნის ურანორგანულ ნაერთებს.
გამოყენება
ბირთვული საწვავი
ყველაზე დიდი გამოყენება აქვს ურანის იზოტოპს 235U, სადაც შესაძლებელია ჯაჭვური რეაქციის თვითშენარჩუნება. ამიტომ ეს იზოტოპი გამოიყენება როგორც საწვავი ბირთვულ რეაქტორებში, ასევე ბირთვულ იარაღში. იზოტოპ U235-ის გამოყოფა ბუნებრივი ურანიდან — რთული ტექნოლოგიური პრობლემაა (იხ. იზოტოპების დაყოფა).
მოვიყვანთ რამდენიმე ციფრს 1000 მვტ სიმძლავრის რეაქტორისათვის, რომელი მუშაობს 80 % დატვირთვით, და გამოიმუშავებს 7000 გვტ·სთ წელიწადში. ასეთ მხოლოდ ერთ რეაქტორს ერთი წლის განმავლობაში ესაჭიროება 20 ნჯყფ ურანის საწვავი რომელიც შეიცავს 3,5 % U-235, და მიიღებენ მიახლოებით 153 ტონა ბუნებრივი ურანის გამდიდრებით.
იზოტოპს U238 შეუძლია გაიყოს მაღალენერგეტიკული ნეიტრონების დაბომბვის ზემოქმედებით, მის ამ თავისებურებას გამოიყენებენ თერმობირთვული იარაღის სიმძლავრის გასაზედელად (გამოიყენება ნეიტრონები, რომლებიც თერმობირთვული რეაქციის დროს ჩნდებია).
238U ნეიტრონის მიტაცებით და შემდგომ β-დაშლით შეიძლება გარდაიქმნას 239Pu-ად, რომელიც შემდგომ გამოიყენება როგორც ბირთვული საწვავი.
ურან-233 რომელიც ხელოვნურად მიიღება რეაქტორებში თორიუმისაგან (თორიუმ-232 მიიტაცებს ნეიტრონს და გარდაიქმნება თორიუმ-233-ად, რომელიც იშლება პროტაქტინიუმ-233 და მერე ურან-233), შეიძლება მომავალში გახდეს გავრცელებული ბირთვული საწვავი ატომური ელექტროსადგურებისათვის (უკვე დღეს არის რეაქტორები, რომლებშიც გამოიყენებენ ამ ნუკლიდს როგორც საწვავს, მაგალითად KAMINI ინდოეთში) და ატომური ბომბების წარმოებაში (კრიტიკული მასა მიახლოებით 16 კგ).
ურან-233 ასევე წარმოადგენს ყველაზე პერსპექტიულ საწვავს გაზოფაზური ბირთვული სარაკეტო ძრავებისათვის.
ურანის თბოგამოყოფის თვისება
1 ტონა გამდიდრებული ურანი თბოგამოყოფის თვისებით 1 მილიონ 350 ათას ტონა ნავთობის ან ბუნებრივი აირის ტოლია.
გეოლოგია
გეოლოგიაში ურანს ძირითადად გამოიყენებენ - მინერალების და მთის ქანების წლოვანების განსასაზღვრავად, გეოლოგიური პროცესების მიმდინარეობის გამოსავლენად. ამითაა დაკავებული გეოქრონოლოგია. განსაკუთრებული მნიშვნელობა აქვს ასევე ნივთიერების ძვრისა და ნივთიერების წყაროების ამოცანების ამოხსნისათვის.
ამოცანის გადაწყვეტის საფუძველი დევს რადიოაქტიური დაშლის განტოლებაში:
სადაც 238Uo, 235Uo — ურანის იზოტოპების თანამედროვე კონცენტრაცია; 

მეტად მნიშვნელოვანია მათი კომბინაცია:
.
აქ
იმის გამო რომ, მთის ქანები შეიცავენ ურანის სხვადასხვანაირ კონცენტრაციას, ისინი ამიტომაც სხვადასხვანაირი რადიოაქტიურობით ხასიათდებიან. ეს თვისება გამოიყენება მთის ქანების გამოყოფისას გეოფიზიკური მეთოდით. განსაკუთრებულად ეს მეთოდი ფართოდ გამოიყენება ნავთობ გეოლოგიაში ჭაბურღილების გეოფიზიკური კვლევების ჩატარებისას, ამ კომპლექსებში შედიან, კერძოდ, γ — კაროტაჟი ან ნეიტრონების გამა-კაროტაჟი, გამა-გამა-კაროტაჟი და ა.შ.[10]. მათი მეშვეობით ხდება ჰიდროგეოლოგიური კოლექტორის და ფლუიდო საყრდენების[11].
გამოყენების სხვა სფეროები
- ურანის მცირედი რაოდენობით დამატება მინას აძლევს ლამაზ მოყვითალო-მომწვანო ფლუორესცენციას (იხ. ურანის მინა)[12]
- ნატრიუმის ურანატი Na2U2O7 გამოიყენებოდა როგორც ყვითელი პიგმენტი მხატვრობაში[12].
- ურანის ნაერთები გამოიყენებოდა როგორც საღებავები ფაიფურის და კერამიკის ნაკეთობებში ასევე მინანქარში (ღებავენ შემდეგ ფერებად: ყვითელი, რუხი, მწვანე და შავი, დაჟანგვის ხარისხის მიხედვით)[12].
- ურანის ზოგიერთი ნაერთი სინათლის მიმართ მგრძნობიარეა[12].
- XX საუკუნის დასაწყისში ურანილნიტრატი ფართოდ გამოიყენებოდა ნეგატივების გასაძლიერებლად და პოზიტივის შესაფერადებლად (ტონირებისათვის) რუხ ფერში[12].
- ურან-235-ის კარბიდი ნიობიუმის კარბიდთან და ცირკონიუმის კარბიდთან ერთად შენადნობი გამოიყენება ბირთვული რეაქტიული ძრავებში როგორც საწვავი (მუშა სხეული — წყალბადი + ჰექსანი).
- რკინისა და გაღარიბებული ურანის (ურან-238) შენადნობი გამოიყენება როგორც მძლავრი მაგნიტოსტრიქციული მასალა
გაღარიბებული ურანი
ბუნებრივი ურანიდან 235U და 234U-ის გამოყოფის შემდეგ, დარჩენილი მასალა (ურან-238) ატარებს «გაღარიბებული ურანის» სახელწოდებას, რადგანაც ის გაღარიბებულია 235-ე იზოტოპით. ზოგიერთი მონაცემებით, აშშ-ში ინახება მიახლოებით 560 000 ტონა გაღარიბებული ურანის ჰექსაფტორიდი (UF6).
გაღღარიბებული ურანი ორჯერ უფრო ნაკლებად რადიოაქტიურია, ვიდრე ბუნებრივი ურანი, ძირითადად იქიდან 234U-ის მოცილების გამო. რადგანაც ურანის ძირითადი გამოყენება ხდება- ენერგიის წარმოებისათვის, გაღარიბებული - ნაკლებადსასარგებლო პროდუქტია დაბალი ეკონომიკური ღირებულებით.
მისი გამოყენება ძირითადად ხდება ურანის დიდი სიმკვრივის და შედარებით დაბალი ღირებულების გამო. გაღარიბებული ურანი გამოიყენება რადიაციულ დაცვაში (რაც არ უნდა უცნაურად ჟღერდეს), — გამოიყენება უაღრესად მაღალი მიტაცების განიკვეთისათვის, და როგორც უფასო მასა აეროკოსმონავტიკაში. «ბოინგ-747-ის» ყოველ თვითმფრინავში არის 1500 კგ გაღარიბებულ ურანი. ასევე ეს მასალა გამოიყენება ჰიროსკოპების მაღალსიჩქარულ როტორებში, ნავთობის ჭაბურღილებში.
ჯავშან საწინააღმდეგო ჭურვის გულსართები

გაღარიბებული ურანის ყველაზე ცნობილი გამოყენება ხდება — როგორც ჯავშან საწინააღმდეგო ჭურვის გულსართები . მაღალი სიმკვრივე (ფოლადზე 3-ჯერ უფრო მძიმეა), გაწრთობილ ურანის ლილვს ხდის უკიდურესად ეფექტურ საშუალებას ჯავშნის გასარღვევად, ეფექტიანობით ანალოგიურია უფრო ძვირი და უფრო მძიმე ვოლფრამის. მძიმე ურანის ცხვირი ცვლის ჭურვის მასების გნაწილებას, აუმჯობესებს მის აეროდინამიკურ მდგრადობას.
«სტაბილას» ტიპის მსგავსი შენადნობები გამოიყენება ისრისმაგვარ ფრთებიან ჯავშანსაწინააღმდეგო სატანკო და ტანკსაწინააღმდეგო საარტილერიო ქვემეხებში.
ჯავშნის გარღვევის პროცესს თან ახლავს ურანის ლილვაკის დაქუცმაცება მტვრად და ჯავშნის მეორე მხარეს ჰაერზე აალება (იხ. პიროფორება). მიახლოებით 300 ტონა გაღარიბებული ურანი დარჩა ბრძოლის ველზე უდაბნოს ქარბუქის» ოპერაციისას, ყოველი ჭურვი შეიცავდა 272 გრამ ურანს.
ასეთი ჭურვები გამოყენებულ იქნა ნატოს ჯარების მიერ საომარ ქმედებებში იუგოსლავიაში[13].
პირველად ჭურვების გულსართად გამოყენებულ იქნა მესამე რეიხის მიერ.
გაღარიბებული ურანი გამოიყენება თანამედროვე ტანკის ჯავშანში, მაგალითად, ტანკ M-1 «აბრამსში».
ფიზიოლოგიური ქმედება

მიკრორაოდენობით (10−5—10−8 %) აღღმოჩენილია მცენარეების, ცხოველების და ადამიანის ქსოვილებში. უფრო გროვდება ზოგიერთ სოკოში და წყალმცენარეებში. ურანის ნაერთები იწოვება კუჭ-ნაწლავის ტრაქტით (მიახლოებით 1 %), ფილტვებით — 50 %. გროვდება განსაკუთრებულად: ელენთაში, თირკმლებში, ჩონჩხში, ღვიძლში, ფილტვებში და ბრონქო-ფილტვების ლიმფურ კვანძებში. ადამიანის და ცხოველების ორგანოებსა და ქსოვილებშიარ აღემატება 10−7გრ.
ურანი და მისი ნაერთები "ტოქსიკურებია". განსაკუთრებით საშიშია ურანისა და მისი ნაერთების აეროზოლები. ურანის წყალში ხსნადი ნაერთებისათვის ზღვრული დასაშვები კონცენტრაცია ჰაერში არის 0,015 მგრ/მ³, ურანის უხსნადი ფორმებისათვის ზდკ- 0,075 მგრ/მ³. ურანის მოხვედრისას ორგანიზმში ის მოქმედებს ყველა ორგანოზე, და წარმოადგენს საერთო უჯრედულ საწამლავს. ურანი პრაქტიკულად შეუქცევად, როგორც სხვა მძიმე ლითონები, უკავშირდება ცილებს, უპირველესად ამინომჟავების სულფიდურ ჯგუფებს, და შლის მათ ფუნქციას. ურანის ქმედების მოლეკულური მექანიზმი დაკავშირებულია მის უნართან დათრგუნოს ფერმენტების აქტიურობა. უპირველეს ყოვლისა ზიანდება თირკმელი (შარდში ჩნდება ცილები, შაქარი და ოლიგურია). ქრონიკული ინტოქსიკაციისას შესაძლებელია სისხლ წარმოქმნის და ნერვიული სისტემის ფუნქციის დარღვევა.
ურანის მარაგი მსოფლიოში
დედამიწის ქერქში ურანის მარაგი მიახლოებით 1000-ჯერ აღემატება ოქროს მარაგს, 30-ჯერ — ვერცხლისას, ამასთან ეს მონაცემი მიახლოებით ტოლია ტყვიის და თუთიის ანალოგიური მაჩვენებელისა. ურანის არც თუ ისე მცირე რაოდენობა გაბნეულია ნიადაგში, მთის ქანებში და ზღვის წყალში. მხოლოდ შეარებით მცირე რაოდენობა კონცენტრირდება საბადოებში, სადაც ამ ელემენტის შემცველობა ასობით აღემატება მის საშუალო შემცველობას დედამიწის ქერქში[14].ურანის დაზვერილი მსოფლიო მარაგი საბადოებში შეადგენს 5,4 მლნ ტონას[15].
ურანის მოპოვება მსოფლიოში

«ურანის წითელი წიგნის» მიხედვით[15], რომელიც გამოცემულია 2005 წ. მოპოვებულია 41 250 ტონა ურანი (2003 — 35 492 ტონა). მსოფლიოში ფუნქციონირებს 440 კომერციული დანიშნულების ბირთვული რეაქტორი და მიახლოებით 60 მეცნიერული რეაქტორი, რომლებიც მოიხმარენ წელიწადში 67 ათას ტონა ურანს. ეს ნიშნავს, რომ მისი მოპოვება საბადოებში უზრუნველყოფს მოხმარების მხოლოდ 60 %-ს (2009 წ. ეს წილი გაიზარდა 79 %-მდე[16]). დანარჩენი ურანი, ენერგეტიკისათვის ან 17,7 %, მიეწოდება მეორადი წყაროებიდან.
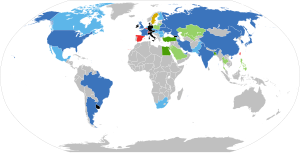
U-ის მოპოვება ქვეყნების მიხედვით ტონებში 2005, 2009 და 2012 წწ
| № | ქვეყანა | 2005 წელი | ქვეყანა | 2009 წელი | ქვეყანა | 2012 წელი |
|---|---|---|---|---|---|---|
| 1 |  კანადა კანადა | 11 410 |  ყაზახეთი ყაზახეთი | 14 020 | ||
| 2 |  ავსტრალია ავსტრალია | 9 044 |  კანადა კანადა | 10 173 | ||
| 3 |  ყაზახეთი ყაზახეთი | 4 020 |  ავსტრალია ავსტრალია | 7 982 | ||
| 4 |  რუსეთი რუსეთი | 3 570 |  ნამიბია ნამიბია | 4 626 | ||
| 5 |  აშშ აშშ | 1 249 |  რუსეთი რუსეთი | 3 564 | ||
| 6 |  უკრაინა უკრაინა | 920 |  ნიგერი ნიგერი | 3 234 | ||
| 7 |  ჩინეთი ჩინეთი | 920 |  უზბეკეთი უზბეკეთი | 2 429 |
მოპოვება კომპანიების მიხედვით 2006, 2009 და 2011 წ. ტონებში
| № | ქვეყანა | კომპანია | 2006 წელი | ქვეყანა | კომპანია | 2009 წელი | ქვეყანა | კომპანია | 2011 წელი |
|---|---|---|---|---|---|---|---|---|---|
| 1 |  კანადა კანადა | Cameco | 8 100 |  საფრანგეთი საფრანგეთი | Areva | 8 600 |  ყაზახეთი ყაზახეთი | KazAtomProm | 11 079 |
| 2 |  ავსტრალია ავსტრალია  დიდი ბრიტანეთი დიდი ბრიტანეთი | Rio Tinto | 7 000 |  კანადა კანადა | Cameco | 8 000 |  კანადა კანადა | Cameco | 9 930 |
| 3 |  საფრანგეთი საფრანგეთი | Areva | 5 000 |  ავსტრალია ავსტრალია  დიდი ბრიტანეთი დიდი ბრიტანეთი | Rio Tinto | 7 900 |  რუსეთი რუსეთი | ARMZ | 7 300 |
| 4 |  ყაზახეთი ყაზახეთი | KazAtomProm | 3 800 |  ყაზახეთი ყაზახეთი | KazAtomProm | 7 500 |  საფრანგეთი საფრანგეთი | Areva | ა/მ |
| 5 |  რუსეთი რუსეთი | ARMZ | 3 500 |  რუსეთი რუსეთი | ARMZ | 4 600 |  ავსტრალია ავსტრალია  დიდი ბრიტანეთი დიდი ბრიტანეთი | BHP Billiton | ა/მ |
| 6 |  ავსტრალია ავსტრალია  დიდი ბრიტანეთი დიდი ბრიტანეთი | BHP Billiton | 3 000 |  ავსტრალია ავსტრალია  დიდი ბრიტანეთი დიდი ბრიტანეთი | BHP Billiton | 2 900 |  ავსტრალია ავსტრალია  დიდი ბრიტანეთი დიდი ბრიტანეთი | Rio Tinto | ა/მ |
| 7 |  უზბეკეთი უზბეკეთი | Navoi | 2 100 |  უზბეკეთი უზბეკეთი | Navoi | 2 400 |  უზბეკეთი უზბეკეთი | Navoi | 2 800 |
| 8 |  კანადა კანადა | Uranium One | 1 000 |  კანადა კანადა  რუსეთი რუსეთი | Uranium One | 1 400 | |||
| 9 |  ავსტრალია ავსტრალია | Heathgate | 800 |  ავსტრალია ავსტრალია | Paladin Energy | 1 200 | |||
| 10 |  კანადა კანადა | Denison Mines | 500 |  აშშ აშშ | General Atomics | 600 |
ღირებულება
მიუხედავად ლეგენდებისა ერთ კილოგრამზე ან გრამებზე ათიათასობით დოლარის ღირებულებისა, რეალური მისი ფასი ბაზარზე არც თუ ისე დიდია — გაუმდიდრებელი ურანის ჟანგის U3O8 ფასი იზრდებოდა $21-დან 2002 წ. იანვარი, მიაღწია პიკს $300 2007 წ-ის შუა.[17], შემდგომ იკლებდა და მერყეობს ახლა $90–130 ერთ კილოგრამზე[18] მატების ტენდენციით. ამასთან ურანის მსოფლიო ბაზარი როგორცასეთი არ არსებობს, მაგ. ოქროსთან განსხვავებით.
ურანის საბადოს დამუშავება რენტაბელურია ურანის 80 დოლ./კგ ღირებულებისას. ახლანდელი ურანის ფასები არ იძლევა საბადოების ეფეკტურ დამუშავებას, ამიტომაც პროგნოზირებენ ფასების მატებას, 75-90 დოლ./კგ 2013—2014 წწ.[19]
2030 წ. მთლიანად იქნება დამუშავებული დიდი და ხელმისაწვდომი საბადოები 80 დოლ./კგ და დაიწყება ძნელად მისაწვდომი საბადოების ათვისება რომლის ღირებულება იქნება 130 დოლ./კგ ურანზე[20].
იხილეთ აგრეთვე
- ბირთვული საწვავი
- ბირთვული რეაქტორი
რესურსები ინტერნეტში
- ი. ნ. ბეკმანი. «ურანი». სასწ. სახ.. ვენა, 2008, მოსკოვი, 2009. (PDF) ფორმატი
- ურანი Webelements-ზე
- ურანი ქიმიური ელემენტების პოპულარულ ბიბლიოთეკაში დაარქივებული 2012-01-14 საიტზე Wayback Machine.
- Nuclear Weapons Frequently Asked Questions
- რუსეთმა აშშ-ს მიჰყიდა იარაღის ურანის მნიშვნელოვანი მარაგი დაარქივებული 2014-08-21 საიტზე Wayback Machine.
- ურანი chemister.ru-ზე


















