რუბიდიუმი
| რუბიდიუმი |
| 37Rb |
| 85.4678 |
| 5s1 |
რუბიდიუმი[1][2] (ლათ. Rubidium; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეხუთე პერიოდის, პირველი ჯგუფის (მოძველებული კლასიფიკაციით — პირველი ჯგუფის მთავარი ქვეჯგუფის, Iა) ქიმიური ელემენტი. მისი ატომური ნომერია — 37, ატომური მასა — 85.468, tდნ — 39.30 °C, tდუღ — 688 °C, სიმკვრივე — 1.532 გ/სმ3. მოვერცხლისფრო-თეთრი ფერის ლითონი. მიეკუთვნება ტუტე ლითონებს. ბუნებრივი რუბიდიუმი ედგება ორი იზოტოპის ნარევისაგან და . 1861 წელს რუბიდიუმი აღმოაჩინეს რ. ბუნზენმა და გ. კირხჰოფმა მინერალების სპექტროსკოპიული ანალიზის დროს. 1863 წელს ლითონური რუბიდიუმი პირველად მიღებულ იქნა რ. ბუნზენის მიერ.
 | |||||||||||||||||||||||||||||||||||||||||||||||
| ზოგადი თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | მოვერცხლისფრო-თეთრი ფერის ლითონი | ||||||||||||||||||||||||||||||||||||||||||||||
| სტანდ. ატომური წონა Ar°(Rb) | 85.4678±0.0003 85.4678±0.001 (დამრგვალებული) | ||||||||||||||||||||||||||||||||||||||||||||||
| რუბიდიუმი პერიოდულ სისტემაში | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| ატომური ნომერი (Z) | 37 | ||||||||||||||||||||||||||||||||||||||||||||||
| ჯგუფი | 1 ჯგუფი (ტუტე ლითონები) | ||||||||||||||||||||||||||||||||||||||||||||||
| პერიოდი | 5 პერიოდი | ||||||||||||||||||||||||||||||||||||||||||||||
| ბლოკი | |||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | [Kr] 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონი გარსზე | 2, 8, 18, 8, 1 | ||||||||||||||||||||||||||||||||||||||||||||||
ელემენტის ატომის სქემა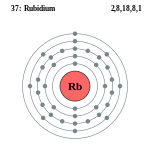 | |||||||||||||||||||||||||||||||||||||||||||||||
| ფიზიკური თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | ||||||||||||||||||||||||||||||||||||||||||||||
| დნობის ტემპერატურა | 39.30 °C (312.45 K, 102.74 °F) | ||||||||||||||||||||||||||||||||||||||||||||||
| დუღილის ტემპერატურა | 688 °C (961 K, 1270 °F) | ||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ო.ტ.) | 1.532 გ/სმ3 | ||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ლ.წ.) | 1.46 გ/სმ3 | ||||||||||||||||||||||||||||||||||||||||||||||
| სამმაგი წერტილი | 312.41 K, კპა | ||||||||||||||||||||||||||||||||||||||||||||||
| კრიტიკული წერტილი | 2093 K, 16 მპა | ||||||||||||||||||||||||||||||||||||||||||||||
| დნობის კუთ. სითბო | 2.19 კჯ/მოლი | ||||||||||||||||||||||||||||||||||||||||||||||
| აორთქ. კუთ. სითბო | 69 კჯ/მოლი | ||||||||||||||||||||||||||||||||||||||||||||||
| მოლური თბოტევადობა | 31.060 ჯ/(მოლი·K) | ||||||||||||||||||||||||||||||||||||||||||||||
ნაჯერი ორთქლის წნევა
| |||||||||||||||||||||||||||||||||||||||||||||||
| ატომის თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||
| ჟანგვის ხარისხი | −1, +1 | ||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროდული პოტენციალი | 2.92 ვ | ||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 0.82 | ||||||||||||||||||||||||||||||||||||||||||||||
| იონიზაციის ენერგია |
| ||||||||||||||||||||||||||||||||||||||||||||||
| ატომის რადიუსი | ემპირიული: 248 პმ | ||||||||||||||||||||||||||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 220±9 პმ | ||||||||||||||||||||||||||||||||||||||||||||||
| იონური რადიუსი (rion) | (+1e)147 პმ | ||||||||||||||||||||||||||||||||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 303 პმ | ||||||||||||||||||||||||||||||||||||||||||||||
| მოლური მოცულობა | 55.9 სმ3/მოლი | ||||||||||||||||||||||||||||||||||||||||||||||
რუბიდიუმის სპექტრალური ზოლები | |||||||||||||||||||||||||||||||||||||||||||||||
| სხვა თვისებები | |||||||||||||||||||||||||||||||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | ||||||||||||||||||||||||||||||||||||||||||||||
| მესრის სტრუქტურა | კუბური მოცულობაცენტრირებული  | ||||||||||||||||||||||||||||||||||||||||||||||
| მესრის პერიოდი | 5.710 Å | ||||||||||||||||||||||||||||||||||||||||||||||
| ბგერის სიჩქარე | 1300 მ/წმ (20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||
| თერმული გაფართოება | 90 µმ/(მ·K) | ||||||||||||||||||||||||||||||||||||||||||||||
| ხვედრითი თბოტევადობა | 31.1 ჯ/(K·მოლ) | ||||||||||||||||||||||||||||||||||||||||||||||
| თბოგამტარობა | 58.2 ვტ/(მ·K) | ||||||||||||||||||||||||||||||||||||||||||||||
| მაგნეტიზმი | პარამაგნეტიკი | ||||||||||||||||||||||||||||||||||||||||||||||
| მაგნიტური ამთვისებლობა | +17.0×10−6 სმ3/მოლ | ||||||||||||||||||||||||||||||||||||||||||||||
| იუნგას მოდული | 2.4 გპა | ||||||||||||||||||||||||||||||||||||||||||||||
| დრეკადობის მოდული | 2.5 გპა | ||||||||||||||||||||||||||||||||||||||||||||||
| მოოსის მეთოდი | 0.3 | ||||||||||||||||||||||||||||||||||||||||||||||
| ბრინელის მეთოდი | 0.216 მპა | ||||||||||||||||||||||||||||||||||||||||||||||
| CAS ნომერი | 7440-17-7 | ||||||||||||||||||||||||||||||||||||||||||||||
| ისტორია | |||||||||||||||||||||||||||||||||||||||||||||||
| აღმომჩენია | რობერტ ბუნზენი და გუსტავ კირხჰოფი (1861) | ||||||||||||||||||||||||||||||||||||||||||||||
| პირველი მიმღებია | George de Hevesy | ||||||||||||||||||||||||||||||||||||||||||||||
| რუბიდიუმის მთავარი იზოტოპები | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| • | |||||||||||||||||||||||||||||||||||||||||||||||
აღმოჩენის ისტორია
1861 წელს გუსტავ კირხჰოფმა და რობერტ ბუნზენმა რუბიდიუმი აღმოაჩინეს მინერალური წყლის აორთქლების შემდეგ მიღებული ნალექის სპექტრის შესწავლით. სახელწოდება „რუბიდიუმი“ მიიღო მისი სპექტრის მეწამური ფერის გამო.
1883 წელს ბუნზენმა პირველად მიიღო მეტალური რუბიდიუმი. რუბიდიუმი ბუნებაში გავრცელებულია ნაერთების სახით. დედამიწის წიაღში მისი შემცველობა უდრის 8,3*10-3 წონით პროცენტს. მეტწილად სილიციუმისა და ალუმინის ოქსიდებთან ერთად კარნალიტი KCl*MgCl2*6H2O მცირე რაოდენობით შეიცავს რუბიდიუმის ქლორიდს (RbCl). რუბიდიუმის მისაღებად, მისი შემცველი მადნები გადაყავთ ხსნადი მარილის-ქლორიდის სულფატის ან ნიტრატის მდგომარეობაში, საიდანაც სპეციალური რეაქციების გამოყენებით გამოყოფენ რუბიდიუმს ნაერათის სახით. მეტალურ რუბიდიუმს იღებენ მისი ნაერთის ნალღობის ელექტროლიზით ვაკუუმში, ან ინერტული გაზის ატმოსფეროში, მას იღებენ აგრეთვე მისი ჰიდროქსიდის აღდგენით:
(900 გრადუსი)
(700 გრადუსი)
იზოტოპები
სტანდარტული ატომური მასა
რუბიდიუმის სტანდარტულ ატომურ მასად მიღებულია — 85,4678, რომელიც როგორც წესი იანგარიშება ბუნებაში არსებულ ყველა სტაბილურ იზოტოპტთა საშუალო შეწონილი მასით, მათი დედამიწის ქერქსა და ატმოსფეროში გავრცელების პროპორციულად.
| იზოტოპი | Z | N | ატომური მასა (მ.ა.ე.) | % ბუნებაში | საშუალო შეწონილი |
|---|---|---|---|---|---|
| 85Rb | 37 | 48 | 84,911789738 | 72,17 % | 61,280839 |
| 87Rb | 37 | 50 | 86,909180527 | 27,83 % | 24,186825 |
| Ar, სტან.(Rb) | 85,46766 |
ფიზიკური თვისებები
ის მსუბუქი ელემენტია, d=1,532გ/სმ3, ვერცხლისფერი, მოცულობა ცენტრისებური კუბური ფორმის ნივთიერებაა, ახასიათებს პარამაგნიტური თვისებები. ცნობილია რუბიდიუმის შენადნობები, მაგალითად ნატრიუმთან რომლის დნობის ტემპერატურა 4,5 გრადუსია, კალიუმთან-32,8 გრადუსი, (Rb+Cs)+9 გრადუსი ლღობის ტემპერატურით რუბიდიუმი რადიოაქტიურია და ახასიათებს ბეტა გამოსხივება.
ქიმიური თვისებები
ქიმიური თვისებებით რუბიდიუმი უფრო აქტიური ლითონია, ვიდრე ლითიუმი, ნატრიუმი და კალიუმი. რიგი ქიმიური თვისებებით, რუბიდიუმი ახლოს არის კალიუმის ქიმიურ თვისებებთან. სუფთა ჟანგბადში რუბიდიუმი იწვის აალებით Rb2O4-ის წარმოქმნით. ის აქტიურად ურთიერთქმედებს წყალთან წყალბადის გამოყოფით, ეს რეაქცია იმდენად ენერგიულია, რომ მიმდინარეობს -180 გრადუსზეც კი. მეტალური რუბიდიუმის სპირტებზე მოქმედებით, რეაქცია ენერგიულად წარიმართება, ადგილი აქვს წყალბადის გამოყოფას და ალკოპოლიატების მიღებას. ფთორისა და ქლორის ატმოსფეროში რუბიდიუმი აალდება, ბრომთან კი რეაქცია აფეთქებით მიმდინარეობს და წარმოიქმნება შესატყვისი ჰალოგენები. ამიაკთან წარმოქმნის რუბიდიუმის ამიდს RbNH2. რუბიდიუმის მარილები რადიოაქტიურია, ისინი კარგად იხსნებიან წყალში, ძნელად ხსნადია რუბიდიუმის შემდეგი მარილები: RbClO4, Rb3Sb2Cl9, Rb2[SnCl6] და სხვა.
რუბიდიუმის ნაერთები
მისი ნაერთების უმრავლესობა უფერო ნივთიერებებია. ის უფრო კუბური ფორმის კრისტალური ნივთიერებაა. იონთაშორის მანძილი 3.02A ტოლია d=2,6გ/სმ3, იშლება 400 გრადუსზე.
- რუბიდიუმის ოქსიდს Rb2O იღებენ მეტალური რუბიდიუმის ვერცხლის ტიგელში ჟანგბადით დაჟანგვისას: 2Rb+1/2O2=Rb2O 2RbNO3+10Rb=6Rb2O+N2
სუფთა რუბიდიუმის ოქსიდის მისაღებად მეტალურ რუბიდიუმს ვერცხლის ტიგერლში მშრალ ჟანგბადთან ერთად ახურებენ ვაკუუმში. ხანგრძლივად წარმოიქმნება Rb2O, რომელიც კუბური კრისტალების სახით რჩება ტიგელში, ხოლო ჭარბი რაოდენობის რუბიდიუმი ორთქლდება და კონდენსირდება ჭურჭლის ცივ ზედაპირზე. რუბიდიუმის ოქსიდი Rb2O გახურებით 400 გრადუსამდე განიცდის დისპროპორცირებას რუბიდიუმის ზეჟანგად და რუბიდიუმად: 2Rb2O=Rb2O2+2Rb
- რუბიდიუმის ზეჟანგდი Rb2O2 შეიძლება მივიღოთ რუბიდიუმის ჟანგბადთან ურთიერთქმედებით: 2Rb+O2=Rb2O2+107კკალ/მოლი
Rb2O2 მკრთალი მოყვითალო ფერის კუბური ფორმის მდგრადი კრისტალური ნივთიერებაა, რომლის t=600 გრადუსს, d=3,65 გ/სმ3.რუბიდიუმის ზეჟანგის გახურებით ვერცხლის ნავში, 300 გრადუსზე წარმოიქმნება შავი ფერის ზეჟანგი Rb2O3, შემდეგ კი RbO2 (Rb2O4).
- Rb2O4 მოყვითალო-ნარინჯისფერი მყარი კრისტალური ნივთიერებაა, ლღვება-280 გრადუსზე, ვაკუუმშიხანგრძლივად შენახვისას იშლება Rb2O3 და ჟანგბადად. Rb2O4-ზე წყლის მოქმედებით მიმდინარეობს რეაქცია:
Rb2O4+2H2O=2RbOH+H2O2+O2
- რუბიდიუმის ჰიდროქსიდი RbOH მიიღება მეტალურ რუბიდიუმზე წყლის მოქმედებით ან მის ოქსიდზე წყლის მოქმედებით და სხვა რეაქციებით: 2Rb+2H2O=2RbOH+H2
Rb2O+H2O=2RbOHRbOH თეთრი ფერის ამორფული მყარი ნივთიერებაა, ძლიერ ჰიგროსკოპიულია, tლღ=30 გრადუსს. ორთქლის მდგომარეობაში გადადის დაუშლელად, ძლიერი ტუტეა.
- რუბიდიუმის ჰალოგენიდები.
- რუბიდიუმის ქლორიდი RbF მიიღება სხვადასხვა რეაქციით, ნეირაციზაციით, ელემენტების უშუალო მოქმედებით, მიმოცვლის რეაქციით და სხვა. 2Rb+F2=2RbF
Rb2CO3+2HF=2RbF+CO2+H2ORbOH+HF=RbF+H2Oმიღებული ხსნარის კონცენტრირებით გამოიყოფა უფერო კუბური კრისტალების სახით, იონთაშორისი მანძილი r=2,82, A, t=ლღ=760 გრადუსს,tდუღ=1410 გრადუსს, ძლიერ ჰიდროსკოპიულია, კარგად იხსნება წყალში და სპირტში.რუბიდიუმის ქლორიდი RbCl მიიღება იმავე გზით როგორიც RbF.Rb2CO3+2HCl=2RBCl+CO2+H2ORbOH+HCl=RbCl+H2ORb ქლორიდი გამოიყოფა უფერო კუბური კრისტალების სახით, იონთაშორის მანძილი r=2.29, A, d=2,762გ/სმ3, tლღ=715 გრადუსს, tდუღ=1383 გრადუსს, ადვილად იხსნება წყალში, ცუდად სპირტში.'რუბიდიუმის ქლორიდი', ზოგიერთი მეტალის ქლორიდთან წარმოქმნის ორმაგ და კომპლექსურ მარილებს, როგორიცაა:Rb3Sb2Cl9, Rb2[SnCl6], Rb2[PtCl6] და სხვა.
- რუბიდიუმის ბრომიდი RbBr მიიღება ქლორიდის ანალოგიურად. უფერო კუბური მესერის მქონე კრისტალური ნივთიერებაა, იონთაშორისი მანძილით 3.43A, d=2,78 გ/სმ4, tლღ=6,81 გრადუსს, tდუღ=1350 გრადუსზე წყალში ადვილად ხსნადია. ცნობილია რუბიდიუმის ბრომიდის პოლიჰალოგენიდები. როგორიცაა:RbBr3, RbBr2Cl და RbCl2Br.
- რუბიდიუმის იოდიდი RBJ მიიღება ნეიტრალიზაციის და სხვადასხვა რეაქციებით:
RbOH+HJ=RbJ+H2ORb2O+2HJ=2RbJ+H2ORb2CO3+2HJ=2RbJ+CO2+H2ORbJ წარმოადგენს უფერო კუბური ფორმის კრისტალურ ნივთიერებას. იონთაშორისი მანძილი r=3,67A, d=3,55გ/სმ3, tლღ=642 გრადუსს, tდუღ=1300 გრადუსს, იხსნება წყალსა და სპირტში. რუბიდიუმის იოდიდის ხსნარზე იოდის მოქმედებით მიიღება რუხი ფერის რუბიდიუმის პოლიოდიდები RbJ3, RbJ7 და RbJ9- 200 გრადუსამდე ფგაცხელებით ისინი იშლებიან.
ცნობილია, აგრეთვე, რუბიდიუმის იოდიდის შერეული პოლიჰალოგენიდები, მაგალითად, RbJBr2 (წითელი ფერის) და RbJBrCl (ნარინჯისფერი).რუბიდიუმის ქლორატი RbClO3 მიიღება რუბიდიუმის სულფატის ხსნარზე ბარიუმის ქლორატის მოქმედებით მიღებული ხსნარის აორთქვლით:Rb2SO4+Ba(ClO3)2=BaSO4+2RbClO3
- რუბიდიუმის სულფიდი Rb2S წარმოადგენს უფერო კუბურ წყალში ხსნად მიკრიკრისტალურ ნივთიერებას, d=2.91გ/სმ3. tლღ=500-600 გრადუსს, თავისი თვისებებით მსგავსია ცეზიუმის სულფიდის. რუბიდიუმის სულფიდს იღებენ გოგირდის ორთქლის მეტალურ რუბიდიუმზე მოქმედებით ან კიდევ რუბიდიუმის მარილის ხსნარში გოგირდწყალბადის გატარებით:
2RbCl+H2S=Rb2S+2HClრუბიდიუმის სულფატი Rb2SO4 მიიღება რუბიდიუმის ჰიდროქსიდზე, ოქსიდზე ან კარბონატზე გოგირდმჟავას მოქმედებით:2RbOH+H2SO4=Rb2SO4+2H2ORb2SO3+H2SO4=Rb2SO4+CO2+H2Oრუბიდიუმი წარმოქმნის სოსირდმჟავას მარილს RbHSO4. RbOH+H2SO4=RbHSO4+H2ORbHSO4 თეთრი კრისტალური ნივთიერებაა, d=2,892გ/სმ3, რომელიც გახურებით გარდაიქმნება პიროსულფატად. 2RbHSO4=Rb2SO2O7
- რუბიდიუმის ნიტრატი RbNO3 მიიღება რუბიდიუმის ჰიდროქსიდის ან კარბონატის ხსნარის აზოტმჟავათი ნეიტრალიზაციით:
RbOH+HNO3=RbNO3+H2ORbOCO3+2HNO3=2RbNO3+H2O+CO2RbNO3 დიამაგნიტური თეთრი ფერის კრისტალური ნივთიერებაა, კრისტალდება სხვადასხვა ფორმის კრისტალების სახით, d=3,131გ/სმ3, კარგად იხსნება წყალში და ცუდად სპირტში, ლღვება 313გრადუსზე იშლება ძლიერ გახურებით.RbNO3=RbNO2+1/2O2აზოტმჟავასთან წარმოქმნის მჟავამარილებს: RbH(NO3)2(RbNO3*HNO3) და RbNO3*2HNO3.
- რუბიდიუმის ფოსფატი Rb3PO4 მიიღება რუბიდიუმის ჰიდროქსიდზე ან კარბონატზე ორტოფოსფორმჟავას მოქმედებით
3RbOH+H3PO4=Rb3PO4+3H2O3Rb2CO3+2H3PO4=2Rb3PO4+3CO2+3H2Oრუბიდიუმი ფოსფორმჟავასთან წარმოქმნის სამი რიგის სრულ, ერთი-, ორჩანაცვლებულ მარილებს:Rb3PO4, Rb2HPO4 და RbH2PO4.თუ ჩვენ Rb2H2PO4 244 გრადუსამდე გავაცხელებთ, მივიღებთ რუბიდიუმის ჰიდროპიროფოსფატს. 2RbH2PO4=Rb2H2P2O7 ცნობილია რუბიდიუმის პოლიმერული მეტაფოსფატი (RbPO3)1
- რუბიდიუმის კარბონატი Rb2CO3 მიიღება რუბიდიუმის ჰიდროქსიდსა და ამონიუმის კარბონატის ხსნართა ნარევის აორთქვლით: 2RbOH+(NH4)2CO3=Rb2CO3+2NH3+2H2O
Rb2CO3 განთხევადი დიამაგნიტური კრისტალური ნივთიერებაა, tლღ=837 გრადუსს, კარგად იხსნება წყალსა და სპირტში.თუ Rb2CO3-ის წყალხსნარში CO20-ს გავატარებთ, მივიღებთ რუბიდიუმის ჰიდროკარბონატს:Rb2CO3+CO2+H2O=2RbHCO3რომელიც ადვილად იხსნება წყალში.
გამოყენება
იყენებენ ფოტოელემენტების კათოდების, დღის სინათლის ლამპების და სხვ. წარმოებაში; რ. უმცირესი რაოდენობით მოიპოვება მცენარისა და ცხოველის ქსოვილებში. ნატრიუმთან, კალიუმთან, ცეზიუმთან, ანთიმონთან და სხვა. ლითონებთან შენადნობების დასამზადებლად.


