シーボーギウム
シーボーギウム(Seaborgium)は、元素記号Sg、原子番号106の化学元素である。アメリカ合衆国の核化学者グレン・シーボーグに因んで名付けられた。合成元素であり、研究室内で作られるが、天然には存在しない。放射性を持ち、最も安定な既知の同位体であるシーボーギウム269の半減期は約14分である[1]。
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外見 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 不明 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 一般特性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称, 記号, 番号 | シーボーギウム, Sg, 106 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分類 | 遷移金属 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族, 周期, ブロック | 6, 7, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子量 | [271] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子配置 | [Rn] 5f14 6d4 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子殻 | 2, 8, 18, 32, 32, 12, 2(推定)(画像) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理特性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 相 | 固体(推定) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度(室温付近) | 35 (推定) g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子特性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 酸化数 | 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共有結合半径 | 143 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| その他 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS登録番号 | 54038-81-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 主な同位体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細はシーボーギウムの同位体を参照 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
周期表上では、dブロック元素である。第7周期元素、第6族元素であり、化学実験により、第6族元素のタングステンのホモログとして振る舞うことが確認されている。シーボーギウムの化学的性質は部分的に確認されており、第6族元素の他の元素の化学的性質から予測されるものと一致している。
1974年、ソビエト連邦とアメリカ合衆国の研究室で、いくつかの原子が合成された。発見と命名の優先権は、ソビエト連邦とアメリカ合衆国の研究者の間で議論となったが、国際純正・応用化学連合(IUPAC)は1997年にこの元素の公式名称をシーボーギウムとすることを決定した。存命人物の名前から命名された元素は、118番元素のオガネソンとこの元素だけである[注釈 1]。
導入
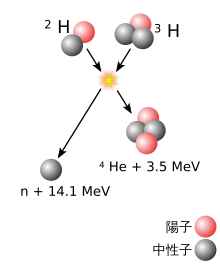
重い[注釈 2]原子核は、2つの異なる原子核[注釈 3]の核融合反応により形成され、おおまかに、2つの原子核の質量の差が大きいほど、反応の可能性は高くなる[8]。重い方の原子核を持つ物質を標的とし、軽い原子核の粒子線を照射することで、2つの原子核が十分に接近すると、1つの原子核への融合が起こりうる。通常、陽電荷を持つ2つの原子核は、クーロンの法則により互いに反発する。原子核同士が非常に近づくときのみ、強い相互作用がこの反発力に打ち克つ。そのため、粒子線となる原子核の速度を、この反発力が無視できる程度まで、加速器で加速する必要がある。ただし、2つの原子核が融合するためには、2つの原子核が単に近づくだけでは不十分である。2つの原子核が近づいただけでは、通常、1つの原子核に融合するのではなく、10-20秒間だけ一緒に留まった後、離れていく(この時、反応前と同じ構成とは限らない)[9][10]。核融合が起こる場合、複合核と呼ばれる一時的な融合状態が励起状態となる。励起エネルギーを失い、より安定な状態に達すると、複合核は核分裂反応を起こすか、1つまたはいくつかの原子核の核破砕反応を起こして、エネルギーを持ち去る[注釈 4]。この事象は、最初の衝突の約10-16秒後に起こる[11][注釈 5]。
粒子線が標的を通り過ぎると、次のチェンバーであるセパレーターに移送される。新しい原子核ができていると、この粒子線により運ばれる[14]。セパレーターでは、生成した原子核は他の原子核(粒子線の原子核やその他の反応生成物)から分離され[注釈 6]、表面障壁型半導体検出器に運ばれる。粒子はそこで停止し、検出器上での正確な衝突位置とそのエネルギー、到達時間が記録される[14]。移送には約10-6秒を必要とし、検出までに原子核はこの長時間を生き残る必要がある[17]。崩壊が起こると、原子核の位置、エネルギー、崩壊時間が再度記録される[14]。
原子核の安定性は、強い相互作用によってもたらされる。しかしそれが及ぶ範囲は非常に短く、原子核が大きくなるほど、最外殻の核子(陽子と中性子)が強い相互作用から受ける影響は小さくなっていく。同時に、陽子間の静電反発により原子核は引き裂かれ、これは範囲の制約がない[18]。そのため、重元素の原子核は、このような反発によるアルファ崩壊や自発核分裂[注釈 7]のようなモードが主要な崩壊過程になると理論的に予測されており[20]、これまで実際の観測もそれを裏付けてきた[21]。このような崩壊モードは、超重元素の原子核には支配的なものである。アルファ崩壊は、放出されたアルファ粒子により記録され、崩壊生成物は実際の崩壊前に容易に決定できる。一度の崩壊や連続した崩壊により既知の原子核が生成されると、計算により反応の出発点となる原子核が決定できる[注釈 8]。しかし、自発核分裂では生成物として様々な原子核が生じ、そのため、娘核からは、出発点となる原子核が決定できない[注釈 9]。
重い元素を合成しようとする物理学者が得られる情報は、このように検出器により収集される、粒子が検出器に衝突した距離、エネルギー、時間と、崩壊の際の同様の情報となる。物理学者はこのデータを分析し、これが新元素によって引き起こされたものであり、他の核種により引き起こされたものではないと結論付けようとする。しばしば、得られたデータは、新元素の生成を確定するには不十分なものであったり、解釈の誤りの元となりうる[注釈 10]。
歴史
1970年にローレンス・リバモア国立研究所のアルバート・ギオルソが104番元素(ラザホージウム)と105番元素(ドブニウム)の発見を主張した後、106番元素の発見を目指して、カリホルニウム249原子核に酸素18を照射する実験が行われた[31]。9.1 MeVのアルファ崩壊が何度か報告され、これは現在では106番元素に由来するものと考えられているが、当時は確定しなかった。1972年、重イオン線形加速器のアップグレードが行われ、これによりチームは実験を繰り返すことができなくなり、またシャットダウン中はデータ分析が行われなくなってしまった[31]。1974年にこの実験が繰り返され、バークレーのチームは、彼らの新しいデータが1971年のデータと一致していることに気付いた。従って、データをより注意深く分析していれば、106番元素は1971年に発見されていたはずである[31]。
2つのグループがこの元素の発見を主張した。106番元素発見の明確な証拠が1974年にユーリイ・オガネシアンの率いるロシアのドゥブナ合同原子核研究所のチームから初めて報告された。このチームは、鉛208及び鉛207原子核を標的として加速したクロム54イオンを照射して合成を行った。半減期が4-10ミリ秒の自発核分裂が合計で51回観測された。チームは、核子移行反応に由来するものを除外した後、この反応の主原因は106番元素の同位体の自発核分裂である可能性が最も高いと結論付けた。この同位体は、当初シーボーギウム259と提案されたが、後にシーボーギウム260と訂正された[32]。
- 208
82Pb + 54
24Cr → 260
106Sg + 2 1
0n - 207
82Pb + 54
24Cr → 260
106Sg + 1
0n
この年の数か月後、カリフォルニア大学バークレー校のグレン・シーボーグ、キャロル・アロンソ、アルバート・ギオルソ、またローレンス・リバモア国立研究所のケネス・ヒューレットを含むチームは、この5年前に104番元素を合成したのと似た装置を用いてカリホルニウム249を標的に酸素18イオンを照射し、半減期0.9±0.2秒のシーボーギウム263mと思われる原子核に由来する、少なくとも70回のアルファ崩壊を観測した[33]。娘核のラザホージウム259と孫娘核のノーベリウム255は、以前に合成されており、ここで観測された性質は、既知の性質と良く一致していた。観測された反応の反応断面積は0.3ナノバーンで、やはり理論的予測と良く一致していた。これらの結果は、このアルファ崩壊がシーボーギウム263mに由来するものであるという確からしさを高めた[32]。
- 249
98Cf + 18
8O → 263m
106Sg + 4 1
0n → 259
104Rf + α → 255
102No + α
105番元素までの発見の場合とは異なり、発見を主張するどちらのチームも新元素への命名の提案を公表しなかったため、新元素命名にかかる論争は一時的に回避されたが、1992年まで続いた。IUPAC/IUPAP超フェルミウム元素作業部会(TWG)は、101番元素から112番元素の発見に関する主張に結論を出すために組織された。106番元素については、ソ連による260Sg発見の主張は証拠が不十分である一方、アメリカによる263Sgの発見の主張は、既知の娘核に基づいており、信頼できると判断された。その結果、TWGは、1993年の報告書の中で、バークレーのチームを公式な発見者として認定した[32]。


シーボーグはかつて、104番元素、105番元素の公式な発見者としてバークレーが認定された場合、106番元素に対しては、ドゥブナのチームに敬意を表して、ドゥブナのチームが104番元素に対して命名を提案していた、ソビエト連邦の核研究を率いたイーゴリ・クルチャトフの名前に因むクルチャトビウム(記号:Kt)という名前を提案すると、TWGに対して言及していた。しかし、TWGの報告の公表後に、バークレーのチームが特に104番元素に関するTWGの決定に激しい異議を唱えたことから両チームの関係が悪化したこともあり、この案は候補から除外された[34]。そのため、正式な発見者として認められた後で、バークレーのチームは本格的に命名の検討を開始した。
...私たちは発見者として認められ、新元素の命名権を得た。ギオルソのグループの8人のメンバーは、アイザック・ニュートン、トマス・エジソン、レオナルド・ダ・ビンチ、フェルディナンド・マゼラン、ユリシーズ、ジョージ・ワシントン、そして(長い間この分野の中心地でも先進地でもなかったが)チームのメンバーの出身地であるフィンランド等に因む広範な命名案を提案した。ある日、アル(ギオルソ)が私のオフィスを訪ねてきて、「シーボーギウム」という命名についてどう思うかと尋ねた。私は床に崩れ落ちた[35]。 — グレン・シーボーグ
シーボーグの息子であるエリックは、命名の経緯について以下のように述懐している[36]。
発見に関わった8名の科学者が非常に良い命名のアイデアを持っていたため、ギオルソは、ある夜、あるアイデアを思いついて目を覚ますまで、合意に達することを絶望的に感じていた。彼は、7人のメンバーが同意するまで、メンバー1人1人を説得した。その後、彼は、50年来の友人であり同僚に対して「106番元素をシーボーギウムと命名することについて、7票が入った。同意してもらえますか?」と語った。私の父は驚きで言葉を失い、母と相談した後、その案に同意した[36]。 — エリック・シーボーグ
シーボーギウムという名前とSgという記号は、1994年3月に開催された第207回アメリカ化学会総会で、発見者の1人であるケネス・ヒューレットにより発表された[35]。しかし、IUPACは1994年8月に、存命人物からの元素の命名を禁止することを決定した。当時、シーボーグは存命であったため、IUPACは翌9月、104番元素から109番元素の発見を主張する3つの研究所(3つ目はドイツの重イオン研究所)から提案された名前をこの6つの新元素に割り当てる案を勧告した。104番元素に対するバークレーからの提案である「ラザホージウム」という名前は106番元素に割り当てられ、シーボーギウムという命名は、元素名としては一旦完全に削除された[34]。
| 原子番号 | 系統名 | アメリカ | ロシア | ドイツ | Compromise 92 | IUPAC 94 | ACS 94 | IUPAC 95 | IUPAC 97 | 現在 |
|---|---|---|---|---|---|---|---|---|---|---|
| 101 | ウンニルウニウム | メンデレビウム | — | — | メンデレビウム | メンデレビウム | メンデレビウム | メンデレビウム | メンデレビウム | メンデレビウム |
| 102 | ウンニルビウム | ノーベリウム | ジョリオチウム | — | ジョリオチウム | ノーベリウム | ノーベリウム | フレロビウム | ノーベリウム | ノーベリウム |
| 103 | ウンニルトリウム | ローレンシウム | ラザホージウム | — | ローレンシウム | ローレンシウム | ローレンシウム | ローレンシウム | ローレンシウム | ローレンシウム |
| 104 | ウンニルクアジウム | ラザホージウム | クルチャトビウム | — | マイトネリウム | ドブニウム | ラザホージウム | ドブニウム | ラザホージウム | ラザホージウム |
| 105 | ウンニルペンチウム | ハーニウム | ニールスボーリウム | — | クルチャトビウム | ジョリオチウム | ハーニウム | ジョリオチウム | ドブニウム | ドブニウム |
| 106 | ウンニルヘキシウム | シーボーギウム | — | — | ラザホージウム | ラザホージウム | シーボーギウム | シーボーギウム | シーボーギウム | シーボーギウム |
| 107 | ウンニルセプチウム | — | — | ニールスボーリウム | ニールスボーリウム | ボーリウム | ニールスボーリウム | ニールスボーリウム | ボーリウム | ボーリウム |
| 108 | ウンニルオクチウム | — | — | ハッシウム | ハッシウム | ハーニウム | ハッシウム | ハッシウム | ハッシウム | ハッシウム |
| 109 | ウンニルエンニウム | — | — | マイトネリウム | ハーニウム | マイトネリウム | マイトネリウム | マイトネリウム | マイトネリウム | マイトネリウム |
| 110 | ウンウンニリウム | ハーニウム | ベクレリウム | ダームスタチウム | — | — | — | — | — | ダームスタチウム |
| 111 | ウンウンウニウム | — | — | レントゲニウム | — | — | — | — | — | レントゲニウム |
| 112 | ウンウンビウム | — | — | コペルニシウム | — | — | — | — | — | コペルニシウム |
この決定は、新元素の発見者が命名権を有するという伝統を無視し、存命人物を元素名の由来とすることを遡及的に禁止するもので、世界的な抗議の嵐が巻き起こった。アメリカ化学会は、104番元素から109番元素に対するアメリカとドイツの他の全ての命名提案とともに、106番元素に対するシーボーギウムという命名を支持し、IUPACの勧告を無視して、学会誌でこれらの命名を承認した[34]。当初、IUPACは自己弁護し、アメリカ人委員は「新元素の発見者は、発見した元素に対して命名を提案する権利を持つが、決定する権利はない。そしてもちろん、私たちはその権利を全く侵害していない」と記した。しかし、シーボーグは次のように答えた。
これは、疑いなく認定された新元素の発見者が、その元素の命名権を否定された歴史上初めての事例だ[35]。 — グレン・シーボーグ
IUPACは世論の圧力に屈して、1995年8月にシーボーギウムの名前を復活させる代わりに、もう1つを除いた他の全てのアメリカの提案を撤回するという妥協案を提示したが、反応はより悪かった。最終的にIUPACは、これらの妥協案を撤回し、1997年8月に最終的な新勧告を出した。この中で、106番元素のシーボーギウムを含む104番元素から109番元素についてのアメリカとドイツの提案をほぼ認定し、ただし、105番元素だけは例外的に、超アクチノイド元素合成の実験手順に対するドゥブナのチームの貢献に敬意を表して、ドブニウムと名付けた。この元素名のリストは、最終的にはアメリカ化学会にも承認され、アメリカ化学会は次のように記した[34]。
国際的的な調和を考慮し、委員会は気が進まないながらも、論文等で長年使用されてきた、アメリカが提案した「ハーニウム」という名前に代わって、「ドブニウム」という元素名を受け入れた。また、106番元素に対する「シーボーギウム」という名前が、今や国際的に承認された元素名となったことを歓迎する[34]。 — アメリカ化学会
シーボーグは、この命名に対して、以下のようにコメントした。
シーボーグはこの1年半後の1999年2月25日に86歳で死去した[35]。
同位体
シーボーギウムのような超重元素は、加速器の中で、より軽い元素を衝突させ、核融合反応を起こさせることにより合成する。シーボーギウムの同位体の大部分はこの方法で直接合成できるが、より重い同位体のいくつかは原子番号のより大きい元素の崩壊生成物としてのみ生成する[38]。
エネルギーに応じて、超重元素を生成する核融合反応は、熱核融合と常温核融合の2種類に分けられる。熱核融合では、非常に軽く高エネルギーの粒子が非常に重い標的(アクチノイド)に向かって加速され、高励起エネルギー(~40-50 MeV)の複合核が形成し、これが核分裂するか、3-5個の中性子を放出する[38]。常温核融合では、合成された融合核は比較的低い励起エネルギー(~10-20 MeV)で、生成した核が核融合反応を起こす可能性は低い。融合した核が基底状態まで冷えると、1つか2つの中性子の放出のみが起こり、より中性子に富んだ生成物ができる。後者は、室温で核融合が達成されることとは、異なる概念である[39]。
シーボーギウムは、安定同位体や天然に存在する同位体を持たない。いくつかの放射性同位体が、2つの原子の融合やより重い元素の崩壊により、研究室内で作られている。原子量258-269と271の13種類の同位体が報告されており、そのうち、原子量261、263、265の3つは準安定状態を持つことが知られている。電子捕獲によりドブニウム261となるシーボーギウム261を唯一の例外として、これら全ての崩壊は、アルファ崩壊か自発核分裂によるものである[40]。
より重い同位体ほど半減期が長い傾向があり、既知の最も重い267Sg、269Sg、271Sgの3つは、数分の半減期を持つ。この領域内のいくつかの他の同位体は、これに匹敵するかより長い半減期を持つと予測される。さらに、263Sg、265Sg、265mSgの3つは、数秒の半減期を持つ。残りの全ての同位体の半減期は、わずか92マイクロ秒の半減期を持つ261mSgを除き、数ミリ秒である[40]。
陽子に富む同位体である258Sg-261Sgは、常温核融合により直接合成され、これより重い同位体は、アクチノイド標的への照射による熱核融合で直接合成できる263mSg、264Sg、265Sg265mSgを除き全て、より重い元素であるハッシウム、ダームスタチウム、フレロビウムからアルファ崩壊を繰り返すことにより生成する。12の同位体の半減期は、261mSgの92マイクロ秒から269Sgの14分までの範囲にある[1][40]。
予測される性質
シーボーギウムやその化合物の性質はほとんど測定されていない。これは、合成が非常に限られておりまた高価であること[8]や非常に早く崩壊することが原因である。いくつかの化学的性質は測定されているが、金属シーボーギウムの性質は未知のままであり、予測値のみが利用可能である。
物理学的性質
標準状態では固体であり、より軽い同族体のタングステンと同様に、結晶構造は体心立方格子になると予測される[41]。初期には、密度が35.0 g/cm3と非常に大きくなると予測されたが[42]、2011年と2013年には、いくらか小さい値である23-24 g/cm3と計算された[43][44]。
化学的性質
シーボーギウムは、6dブロックの4番目の遷移元素である。周期表上ではクロム、モリブデン、タングステンの下に位置し、最も重い第6族元素である。第6族の全ての元素は、様々なオキソアニオンを形成する。+6の酸化状態を取りやすいが、これはクロムの場合は高い酸化状態であり、第6族の下の方の元素ほど安定する。実際に、タングステンは最後の5d遷移金属で、4つ全ての5d電子が金属結合に関与している[45]。同様に、シーボーギウムは気相及び水溶液の両方で+6の酸化状態が最も安定であり、実験的に知られている唯一の酸化状態である。+5と+4の酸化状態は安定性が低く、クロムでは最も一般的な+3の状態は、シーボーギウムでは最も安定性が低い[42]。
6d軌道と7s軌道のエネルギーが近いことから7s軌道が相対論的に安定化する一方、6d軌道が相対論的に不安定化するため、このように最も高い酸化状態が安定になる現象は、6dブロックの初期の元素で起こる。この現象は第6周期で大きくなるため、シーボーギウムは7s電子の前に6d電子を失うと予測されている(Sg, [Rn]5f146d47s2; Sg+, [Rn]5f146d37s2; Sg2+, [Rn]5f146d37s1; Sg4+, [Rn]5f146d2; Sg6+, [Rn]5f14)。7s軌道が大きく不安定化するため、SgIVはWIVよりも不安定であり、SgVIに非常に容易に酸化される。6配位のSg6+のイオン半径は65 pm、原子半径は128 pmと予測される。それにも関わらず、最も高い酸化状態の安定性はLrIII > RfIV > DbV > SgVIの順に低下すると予測される。酸性水溶液中のシーボーギウムイオンの標準還元電位は、以下のように予測されている[42]。
2 SgO3 + 2 H+ + 2 e-  Sg2O5 + H2O
Sg2O5 + H2OE0 = -0.046 V Sg2O5 + 2 H+ + 2 e-  2 SgO2 + H2O
2 SgO2 + H2OE0 = +0.11 V SgO2 + 4 H+ + e-  Sg3+ + 2 H2O
Sg3+ + 2 H2OE0 = -1.34 V Sg3+ + e-  Sg2+
Sg2+E0 = -0.11 V Sg3+ + 3 e-  Sg
SgE0 = +0.27 V
シーボーギウムは非常に揮発性の高い六フッ化物(SgF6)の他に、適度な揮発性を持つ六塩化物(SgCl6)、五塩化物(SgCl5)、酸塩化物(SgO2Cl2及びSgOCl4)を形成する。SgO2Cl2はシーボーギウムの酸塩化物の中では最も安定であると推測され、第6族元素の酸塩化物の中では最も揮発性が低い(MoO2Cl2 > WO2Cl2 > SgO2Cl2)。SgCl6やSgOCl4は、MoCl6やMoOCl4と同様に、高温では不安定で、シーボーギウム(V)に分解すると予測される。SgO2Cl2では、Sg-Cl結合長は似ているものの、HOMO/LUMOのエネルギーギャップがずっと大きいため、この分解は起こらない。
モリブデンとタングステンは互いに非常に似ているが、より小さなクロムとはかなり違いがある。シーボーギウムは、タングステンとモリブデンの化学的性質に非常によく似ていると予想され、さらに多種多様なオキソアニオンを形成する。その中で最も単純なものはシーボーグ酸塩SgO2-である。これはSg(H2O)6+6の急速加水分解により形成されるが、シーボーギウムが大きいため、モリブデンやタングステンと比べて形成は容易ではない。フッ化水素酸中では、低濃度ではタングステンと比べて加水分解されにくいが、高濃度では加水分解されやすく、SgO3F-やSgOF5-等の錯体も形成する。フッ化水素酸中で、錯体の形成は加水分解と競合する[42]。
シーボーギウムに関する実験
シーボーギウムの化学実験は、一度に1つの原子を生成する必要があること、半減期の短さ、またその結果、厳しい実験条件が必要になることから、容易ではなかった[46]。265Sg及びその異性体の265mSgは放射化学の実験を行いやすい。これらは、248Cm(22Ne,5n)の反応により生成する[47]。
シーボーギウムの化学実験は、1995-1996年に初めて行われた。シーボーギウム原子は248Cm(22Ne,4n)266Sgの反応により合成され、加熱されてO2/HCl混合物と反応させられた。生じた酸塩化物の吸着特性が測定され、モリブデンやタングステンの化合物と比較された。この結果は、シーボーギウムが他の第6族元素と似た揮発性の酸塩化物を形成することを示しており、第6族の酸塩化物の揮発性が減少する傾向が確かめられた。
- Sg + O2 + 2 HCl → SgO2Cl2 + H2
2001年、ある研究チームは、H2環境下でシーボーギウムを酸素と反応させ、気相化学の研究を続けた。酸塩化物を形成するのと似た方法で、実験の結果は、より軽い同族体や擬同族体のウランでよく知られているように、シーボーギウムの水酸化酸化物が形成された[48]。
- 2 Sg + 3 O2 → 2 SgO3
- SgO3 + H2O → SgO2(OH)2
シーボーギウムの水溶液の化学については、多くの予測が確認されている。1997-1998年に行われた実験では、シーボーギウムは、HNO3/HF溶液を用いて、恐らくSgO2-4ではなく、中性のSgO2F2または陰イオン錯体[SgO2F3]-として陽イオン交換樹脂から溶出した。対照的に、0.1 Mの硝酸では、モリブデンやタングステンの場合とは異なり、シーボーギウムは溶出せず、モリブデンやタングステンの加水分解が中性の[MO2(OH)2)]に進むのに対し、[Sg(H2O)6]6+の加水分解が陽イオン錯体[Sg(OH)4(H2O)]2+または[Sg(OH)3(H2O)H2]+まで進むことを示唆している[42]。
+6以外で知られているシーボーギウムの唯一の酸化状態は、0である。各々ヘキサカルボニルクロム、ヘキサカルボニルモリブデン、ヘキサカルボニルタングステンを形成する同族体と同様に、ヘキサカルボニルシーボーギウム(Sg(CO)6)が形成されることが2014年に示された。モリブデン及びタングステンのホモログと同様に、ヘキサカルボニルシーボーギウムは揮発性であり、二酸化ケイ素と容易に反応する[46]。
脚注
出典
関連文献
- Audi, G.; Kondev, F. G.; Wang, M. et al. (2017). “The NUBASE2016 evaluation of nuclear properties”. Chinese Physics C 41 (3): 030001. Bibcode: 2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- Beiser, A. (2003). Concepts of modern physics (6th ed.). McGraw-Hill. ISBN 978-0-07-244848-1. OCLC 48965418
- Hoffman, D. C.; Ghiorso, A.; Seaborg, G. T. (2000). The Transuranium People: The Inside Story. World Scientific. ISBN 978-1-78-326244-1
- Kragh, H. (2018). From Transuranic to Superheavy Elements: A Story of Dispute and Creation. Springer Science+Business Media. ISBN 978-3-319-75813-8
- Zagrebaev, V.; Karpov, A.; Greiner, W. (2013). “Future of superheavy element research: Which nuclei could be synthesized within the next few years?”. Journal of Physics: Conference Series 420 (1): 012001. arXiv:1207.5700. Bibcode: 2013JPhCS.420a2001Z. doi:10.1088/1742-6596/420/1/012001. ISSN 1742-6588.
外部リンク
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Seaborgium
- Seaborgium at The Periodic Table of Videos (University of Nottingham)
- WebElements.com - Seaborgium


