Cesio
O cesio é un elemento químico de símbolo Cs e número atómico 55. É un metal alcalino brando de cor prateada-dourada, cun punto de fusión de 28,44 °C (301,59 K), un dos únicos cinco metais elementais que se poden atopar en estado líquido a temperatura ambiente.[a] As súas propiedades físicas e químicas aseméllanse ás do rubidio e ás do potasio. É extremadamente reactivo e pirofórico, reaccionando coa auga a temperaturas de ata −116 °C (157 K). É o elemento químico menos electronegativo e só ten un isótopo estable, o cesio-133. Obtense principalmente da extracción do mineral polucita, mentres que os seus radioisótopos, en especial o cesio-137 que é un produto de fisión, obtéñense dos residuos producidos polos reactores nucleares.
Cesio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liñas espectrais do Cesio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información xeral | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | Cesio, Cs, 55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Alcalinos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 1, 6, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade | 1879 kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza | 0,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparencia | Prateado dourado | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N° CAS | 7440-46-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N° EINECS | 231-155-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 132,90545196[1] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio medio | 260 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atómico (calc) | 298 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio covalente | 244±11 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio de van der Waals | 343 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Xe]6s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electróns por nivel de enerxía | 2, 8, 18, 18, 8, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | +1, −1[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | base forte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estrutura cristalina | cúbica centrada no corpo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 301,59[3] K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebulición | 944 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 63,9 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 2,092 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 2,5 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividade (Pauling) | 0,79 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específica | 240 J/(K·kg) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade eléctrica | 4,89 × 106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 35,9 W/(K·m) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª Enerxía de ionización | 375,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª Enerxía de ionización | 2234,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª Enerxía de ionización | 3400 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª Enerxía de ionización | {{{E_ionización4}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª Enerxía de ionización | {{{E_ionización5}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª Enerxía de ionización | {{{E_ionización6}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7.ª Enerxía de ionización | {{{E_ionización7}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8.ª enerxía de ionización | {{{E_ionización8}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9.ª Enerxía de ionización | {{{E_ionización9}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10.ª Enerxía de ionización | {{{E_ionización10}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos máis estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades segundo o SI e en condicións normais de presión e temperatura, salvo indicación contraria. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Foi descuberto no ano 1860 polos científicos alemáns Robert Bunsen e Gustav Kirchhoff mediante o método de análise espectral. O seu nome procede do latín caesius, que significa "azul ceo". As primeiras aplicacións a pequena escala deste elemento foron en tubos de baleiro e células fotoeléctricas. En 1967, baseándose na definición da velocidade da luz de Einstein como a dimensión máis constante do universo, o Sistema Internacional de Unidades illou dúas emisións de ondas específicas do espectro do cesio-133 para definir as medidas do segundo e do metro. Dende entón o cesio foi empregado habitualmente en reloxos atómicos de alta precisión.
Dende os anos 1990 a súa principal aplicación foi en forma de formiato de cesio para fluídos de perforación, pero tamén se emprega o elemento en aplicacións eléctricas, electrónicas e químicas. O isótopo radioactivo cesio-137 ten unha vida media duns 30 anos e úsase en aplicacións médicas, industriais e hidrolóxicas. O elemento presenta unha toxicidade media e considérase un metal perigoso, e os seus radioisótopos supoñen un risco para a saúde cando se liberan no ambiente.
Características
Propiedades físicas

O cesio é un elemento moi brando (0,2 Mohs) e dúctil, de cor pálida que se escurece na presenza de osíxeno.[4][5][6] O seu punto de fusión é de 28,4 °C (301,5 K), o que o converte nun dos poucos metais elementais que se poden atopar en estado líquido a temperatura ambiente. O mercurio é o único outro metal coñecido cun punto de fusión máis baixo que este elemento.[b][8] Tamén presenta un baixo punto de ebulición, 641 °C (914 K), o segundo máis baixo de tódolos metais.[9] Os seus compostos arden cunha cor azul [10][11] ou violeta.[11]
Forma aliaxes con outros metais alcalinos (agás co litio) e co ouro, así como amálgamas co mercurio. A temperaturas por baixo dos 650 °C (923 K) non forma aliaxes co cobalto, ferro, molibdeno, níquel, platino, tántalo ou volframio. Tamén forma compostos intermetálicos co antimonio, galio, indio e torio, que son fotosensitivos.[4] A aliaxe de menor concentración molar está formada por un 41% de cesio, 47% de potasio e 12% de sodio, e ten o punto de fusión máis baixo de tódalas aliaxes metálicas coñecidas, −78 °C (195 K).[8][12] Algunhas das súas amálgamas foron obxecto de estudo, como CsHg
2 que é de cor negra cun lustre metálico púrpura, mentres que CsHg é de cor dourada, tamén cun lustre metálico.[13]
Propiedades químicas
O cesio é altamente reactivo e pirofórico. É capaz de entrar en ignición de forma espontánea no aire, e reacciona de forma explosiva coa auga incluso a baixas temperaturas, máis que o resto de membros dos metais alcalinos da táboa periódica.[4] Esta reacción coa auga pode darse a temperaturas de ata −116 °C (157 K),[8] o que fai que se clasifique como un material perigoso. Almacénase e transpórtase dentro de hidrocarbonos saturados secos, como o aceite mineral. Así mesmo debe manexarse baixo unha atmosfera de gas inerte, como por exemplo argon. Porén, as explosións de cesio-auga adoitan ser menos potentes que as de sodio-auga en iguais concentracións de cesio e sodio. Isto é así xa que o cesio estoura no mesmo instante de contacto coa auga, deixando moi pouco tempo como para que se acumule o hidróxeno.[14] Pode almacenarse en ampolas de vidro borosilicatado, aínda que para cantidades maiores de 100 gramos o transporte realízase dentro de contedores de aceiro inoxidable pechados hermeticamente.[4]
A química do cesio é semellante á dos outros metais alcalinos, en particular á do rubidio, que se atopa directamente enriba del na táboa periódica.[15] O seu estado de oxidación máis común é o +1, aínda que os haluros deste elemento conteñen o anión Cs− e polo tanto atópanse no estado de oxidación −1.[2] Un estudo de 2013 indicou que baixo condicións de presión extrema (máis de 30 GPa), os electróns internos 5p poderían formar ligazóns químicas, onde o cesio se comportaría como o sétimo elemento 5p, indicando que baixo este tipo de condicións poderían existir fluoruros de cesio con estados de oxidación deste elemento que variarían dende o +2 ata o +6.[16] Algunhas diferenzas co resto de alcalinos danse no feito de que ten maior masa atómica e electropositividade que os outros membros non radioactivos deste grupo.[17] O cesio é o elemento químico de maior electropositividade,[c][8] e o seu ión presenta un tamaño maior que o resto de elementos alcalinos máis lixeiros.[19]
Abundancia

O cesio é un elemento relativamente escaso, con estimacións que indican unha presenza aproximada de 3 partes por millón deste elemento na codia terrestre.[20] Isto posiciónao como o 45º elemento químico máis abundante, e o 36º metal máis común. É máis abundante que elementos como o antimonio, cadmio, estaño e volframio, e dúas ordes de magnitude máis abundante que o mercurio e a prata. Non obstante, a súa abundancia é de tan só un 3,3% en comparación co rubidio, o elemento ao que máis se asemella quimicamente.[4]
Por mor do seu gran raio iónico, o cesio é un dos denominados "elementos incompatibles".[21] Durante o proceso de cristalización fraccionada o cesio concéntrase na fase líquida e cristaliza en último lugar.[22] Isto provoca que os maiores depósitos de cesio se atopen en corpos minerais de pegmatita formados por este proceso de enriquecemento.[23] Como o cesio non se substitúe polo potasio de forma tan doada como o rubidio, os minerais alcalinos silvina (KCl) e carnalina (KMgCl
3·6H
2O) adoitan conter tan só un 0,002% deste elemento. Poden atoparse tamén pequenas cantidades porcentuais de cesio no berilo (Be
3Al
2(SiO
3)
6) e na avogadrita ((K,Cs)BF
4). Dáse en concentracións de ata un 15 % de Cs2O na pezzottaíta (Cs(Be2Li)Al2Si6O18), ata un 8,4 % na londonita ((Cs,K)Al
4Be
4(B,Be)
12O
28), e en menor concentración no mineral máis común rodicita.[4] A única fonte mineral de cesio con importancia económica é a polucita Cs(AlSi
2O
6), que se atopa en diversas partes do mundo con presenza de minerais de pegmatita, e está asociado a outros minerais de litio de maior importancia económica como a lepidolita e a petalita.[23][24]
Unha das maiores fontes deste metal é a Mina Tanco en Bernic Lake, Manitoba, Canadá. Os depósitos alí atopados estímanse nunhas 350 000 toneladas de mineral de polucita, o que representa máis de dous terzos das reservas mundiais deste mineral.[24][25] Malia que o contido estoiquiométrico do cesio na polucita é dun 42,6%, as mostras de polucita puras deste depósito conteñen ao redor dun 34% de cesio,[25] mentres que a polucita que se comercializa contén ao redor dun 19% deste metal.[26] O depósito de pegmatita do Distrito de Bikita, en Cimbabue, trabállase para extraer petalita principalmente, pero tamén contén unha cantidade significativa de polucita, que tamén se pode atopar en cantidades notables na Rexión Erongo de Namibia.[25] Segundo estimacións feitas pola axencia U.S. Geological Survey no 2009, as reservas totais mundiais de cesio serían dunhas 70 000 toneladas.[25]
Isótopos
O cesio ten un total de 39 isótopos coñecidos, que varían en número másico dende 112 ata 151. Varios destes isótopos sintetízanse dende elementos máis lixeiros mediante un lento proceso de captura de neutróns dentro das estrelas máis lonxevas,[27] así como no interior das supernovas.[28] Porén, o único isótopo estable do cesio é 133Cs, con 78 neutróns. Aínda que posúe un spin nuclear grande (7/2+), poden realizarse estudos de resonancia magnética nuclear con este isótopo a unha frecuencia resoante de 11,7 MHz.[29]
O isótopo radioactivo 135Cs ten unha vida media de aproximadamente 2,3 millóns de anos, a máis longa de tódolos isótopos radioactivos deste elemento. 137Cs e 134Cs teñen vidas medias de 30 e 2 anos respectivamente. 137Cs descomponse en 137mBa por emisións beta e posteriormente en bario non radioactivo, mentres que 134Cs transfórmase en 134Ba directamente. Os isótopos de número másico 129, 131, 132 e 136 teñen vidas medias de entre un día e dúas semanas, e o resto de isótopos teñen vidas medias non superiores a un segundo. Existe un total de polo menos 21 isómeros nucleares metaestables, todos eles moi inestables e con vidas medias duns poucos minutos.[30][31] 135Cs é tamén un dos produtos de gran lonxevidade resultantes da fisión do uranio que se forman nos reactores nucleares.[32] Porén, esta produción é reducida na maioría de reactores, xa que o seu predecesor 135Xe é un veleno nuclear moi potente e transmútase habitualmente a un 136Xe estable antes de que poida decaer ata 135Cs.[33][34]

O isótopo 137Cs é un potente emisor de radiación gamma debido ao seu decaemento por emisións beta.[36] A súa vida media convérteo no principal produto de lonxevidade media xunto ao 90Sr que resultan da fisión nuclear do uranio, sendo ámbolos dous responsables da radioactividade do combustible nuclear esgotado, que pode durar varios centos de anos tralo uso deste.[37] Como exemplo, no ano 2005 estimouse que o 137Cs xunto ao 90Sr estaban a ser a principal fonte de radioactividade na área afectada polo accidente de Chernóbil.[38] O tratamento do 137Cs por medio de captura de neutróns non é factible debido ao baixo ritmo de captura, o que provoca que se teña que permitir o decaemento natural deste isótopo.[39]
Case todo o cesio producido como resultado da fisión nuclear procede das emisións beta de produtos de fisión orixinariamente máis ricos en neutróns, pasando por varios isótopos de iodo e xenon.[40] Xa que estes dous elementos son volátiles e poden difundirse a través do combustible nuclear ou polo aire, o cesio radioactivo adoita formarse lonxe do sitio orixinal no que teña lugar a fisión.[41] As primeiras probas nucleares dos anos 1950 liberaron isótopos de 137Cs na atmosfera terrestre, que posteriormente retornaron á superficie da terra como parte da consecuente chuvia radioactiva.[4]
Compostos
A gran maioría dos compostos de cesio conteñen este elemento en forma de catión Cs+
, que forma enlaces iónicos cunha ampla variedade de anións, sendo a excepción máis notable a esta maioría o anión cesiuro (Cs−
) e varios dos óxidos do elemento.[2]
Os sales de Cs+ son invariablemente incoloros agás nos casos nos que a unión en si mesma presente coloración. Moitos dos sales simples son higroscópicos, aínda que en menor medida que os sales correspondentes doutros metais alcalinos máis lixeiros. Os fosfatos[42] acetatos, carbonatos, haluros, óxidos, nitratos e sulfatos deste elemento son solubles en auga. As sales dobres presentan unha menor solubilidade, como no caso do sulfato de aluminio-cesio, empregado na purificación de Cs nos seus minerais. Outros sales dobres con baixa solubilidade son os de antimonio (p.ex.: CsSbCl
4), bismuto, cadmio, cobre, ferro e chumbo.[4]
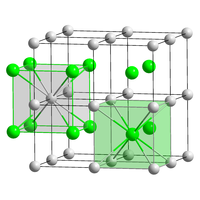
Ao igual que outros catións metálicos, Cs+ forma compostos con solucións en bases Lewis. Debido ao seu gran tamaño, Cs+ adopta habitualmente números de coordinación maiores que seis, comportamento habitual nos catións de metais alcalinos máis lixeiros. Este padrón é aparente na oitava coordinación no CsCl, que contrasta con outros cloruros de metais alcalinos. Este número de coordinación elevado e a súa tendencia para formar enlaces covalentes son as bases da separación de Cs+ doutros catións, práctica empregada no tratamento de residuos nucleares onde se separa o 137Cs+ de grandes cantidades de K+ non radioactivo.[43]
O hidróxido de cesio (CsOH) é higroscópico e unha base moi forte,[15] que actúa como augaforte moi rapidamente na superficie de semicondutores como por exemplo o silicio.[44] O CsOH estivo considerado durante un tempo polos químicos como a base máis forte, reflectindo a relativamente débil atracción experimentada entre os grandes ións Cs+ e o grupo OH−.[10] Este composto é de feito a base Arrhenius máis forte, aínda que hai unha serie de compostos que non poden existir en solucións acuosas, como o n-butil-litio e a amina de sodio, que son máis básicos.[15]
As mesturas estoiquiométricas de cesio e ouro reaccionan para formar un aururo de cesio (Cs+Au−) de cor amarela ao quentarse. Nestes casos o anión aururo compórtase como un pseudohalóxeno. O composto reacciona de forma violenta coa auga, producindo hidróxido de cesio, ouro metálico e gas de hidróxeno. Baixo amoníaco líquido este composto pode facerse reaccionar cunha resina específica de cesio de intercambio de ións para producir tetrametilamonio de aururo. O composto análogo de platino, o platinuro de cesio (Cs2Pt), contén o ión platinuro que se comporta como un pseudocalcóxeno.[45]
Haluros

O fluoruro de cesio (CsF) é un sólido higroscópico de cor branca, empregado na química orgánica do flúor como fonte do anión fluoruro.[47] Este composto ten unha estrutura compacta, na que as compoñentes Cs+ e F− xúntanse nun arranxo cúbico compacto da mesma forma que fan o Na+ e o Cl− no cloruro de sodio.[15]
O cloruro de cesio (CsCl) cristaliza en forma de sistema cúbico simple. Tamén denominada "estrutura do cloruro de cesio",[17] este deseño estrutural componse dun entramado cúbico cunha base de dous átomos, cada un deles cunha coordinación de número 8. Os átomos de cloruro sitúanse nos puntos do entramado dos extremos do cubo, mentres que os átomos de cesio sitúanse nos ocos do centro dos cubos. Esta estrutura é igual á do bromuro de cesio (CsBr) e á do ioduro de cesio (CsI), así como á de moitos outros compostos que non conteñen cesio.[48]
Óxidos
O cesio forma numerosos compostos binarios co osíxeno, máis que o resto de metais alcalinos. Cando arde no aire, o principal produto desta reacción é o superóxido CsO
2.[49] O monóxido de cesio (Cs
2O) forma cristais hexagonais de cor amarela-laranxa,[50] sendo o único óxido coñecido de tipo anti-CdCl
2.[51] Vaporízase a unha temperatura de 250 °C (523 K), e descomponse en metal de cesio e no peróxido Cs
2O
2 a temperaturas por riba dos 400 °C (673 K).[52] A maiores do superóxido e do ozonuro CsO
3,[53][54] existen varios subóxidos do cesio de cores brillantes que tamén foron obxecto de estudo.[55] Estes inclúen os compostos Cs
7O, Cs
4O, Cs
11O
3, Cs
3O (verde escuro[56]), CsO, Cs
3O
2,[57] así como o Cs
7O
2.[58][59] Este último pode quentarse en condicións de baleiro para xerar Cs
2O.[51] Tamén existen outros compostos binarios con xofre, selenio e telurio.[4]
Historia
No ano 1860 Robert Bunsen e Gustav Kirchhoff descubriron o cesio na auga mineral de Dürkheim, Alemaña. Debido ás liñas de cor azul brillante do seu espectro de emisións, escolleron un nome derivado do latín caesius, que significa "azul-ceo".[d][61][62] O cesio foi o primeiro elemento descuberto polo método da espectroscopia.[8][62]
Para obter unha mostra pura de cesio, evaporaron 44 000 litros de auga mineral para conseguir 240 kg de solución salina concentrada. Os metais alcalinotérreos precipitáronse en forma de sulfatos ou oxalatos, deixando o metal alcalino na solución. Tras unha conversión aos nitratos e unha extracción con etanol, obtiveron unha mestura libre de sodio. Deste produto, precipitaron o litio con carbonato de amoníaco. O potasio, rubidio e cesio forman sales non solubles en ácido cloroplatínico, pero estes sales presentan unha lixeira diferenza de solubilidade na auga quente, polo que os hexacloroplatínidos de cesio e rubidio ((Cs,Rb)2PtCl6), menos solubles, puideron obterse por medio de cristalización fraccionada. Tras unha redución do hexacloroplatínido con hidróxeno, conseguiron separar o cesio e o rubidio pola diferenza de solubilidade dos seus carbonatos en alcohol. Este proceso deu como resultado 9,2 g de cloruro de rubidio e 7,3 g de cloruro de cesio, partindo dos 44 000 litros de auga mineral iniciais.[61]

Os dous científicos empregaron o cloruro de cesio así obtido para facer unha estimación do peso atómico do novo elemento, ao que deron un valor de 123,35 (en comparación co finalmente aceptado de 132,9).[61] Tentaron producir cesio elemental por medio da electrólise de cloruro de cesio fundido, pero no canto dun metal obtiveron unha substancia homoxénea de cor azul que non amosaba trazas metálicas nin a simple vista nin baixo un microscopio, e como resultado definírono como un composto non estoiquiométrico (Cs
2Cl), cando en realidade este produto foi unha mestura coloidal do metal elemental e do cloruro de cesio.[63] A electrólise da solución acuosa de cloruro cun ánodo de mercurio produciu unha amálgama de cesio descomposta nesas condicións acuosas.[61] O metal puro sería eventualmente illado polo químico alemán Carl Setterberg mentres traballaba no seu doutoramento con Kekulé e Bunsen.[62] No ano 1882 conseguiu producir cesio metálico por medio da electrólise de cianuro de cesio, evitando os problemas experimentados anteriormente co cloruro.[64]
O uso máis importante do cesio foi historicamente nos campos de investigación, principalmente nos da química e da electricidade. Ata os anos 1920 existiron moi poucas aplicacións industriais para este elemento, momento no que se comezou a empregar en tubos de baleiro para radios. Nesta aplicación tiña dúas funcións: eliminar o exceso de osíxeno remanente trala manufactura, e como recubrimento do cátodo para incrementar a súa condutividade eléctrica.[65][66] O cesio non foi recoñecido como un metal industrial de alto rendemento ata os anos 1950,[67] cando comezou a aplicarse en células fotoeléctricas, tubos fotomultiplicadores, compoñentes ópticos de espectroscopios infravermellos, como catalizador para diversas reaccións orgánicas, en xeradores magnetohidrodinámicos[4] e como fonte de ións positivos na técnica de espectrometría de masas por ións secundarios (SIMS).[68]
Dende 1967 o Sistema Internacional de Unidades basea a súa unidade de tempo, o segundo, nas propiedades do cesio. O SI definiu o segundo como a duración de 9 192 631 770 ciclos a unha frecuencia de microondas da liña espectral correspondente á transición entre dous niveis de enerxía hiperfinos do estado fundamental do cesio-133.[69][70]
Produción
A extracción de mineral de polucita é un proceso selectivo e faise a pequena escala en comparación con outras operacións mineiras. O mineral machúcase, seleccionase a man, habitualmente sen pasar un proceso de concentración, e finalmente lévase ata un estado fundamental. Neste punto extráese o cesio, principalmente por medio de tres métodos: dixestión ácida, descomposición alcalina e redución directa.[4][71]
No proceso de dixestión ácida, a rocha de polucita disólvese con ácidos fortes, como o ácido clorhídrico (HCl), o ácido sulfúrico (H
2SO
4), o ácido bromhídrico ou o ácido fluorhídrico (HF). Empregar o ácido clorhídrico dá como resultado unha mestura de cloruros solubles, e os sales dobres insolubles de cesio precipítanse como cloruro de antimonio-cesio (Cs
4SbCl
7), cloruro de iodo-cesio (Cs
2ICl) ou hexaclorocerato de cesio (Cs
2(CeCl
6)). Trala separación, o sal puro precipitado descomponse, obtendo CsCl puro ao evaporarse a auga.[71][72] O método que emprega ácido sulfúrico produce o sal dobre insoluble directamente en forma de alume de cesio (CsAl(SO
4)
2·12H
2O). O sulfato de aluminio contido neste sal convértese en óxido de aluminio insoluble tostando o alume con carbono, e o produto resultante sométese a un proceso de lixiviación con auga para producir unha solución de Cs
2SO
4.[4][71]
O proceso de tostado da polucita con carbonato de calcio e cloruro de calcio produce silicatos de calcio insolubles e un cloruro de cesio soluble. Unha lixiviación con auga ou amoníaco diluído (NH
4OH) da como resultado unha solución diluída de cloruro (CsCl).[4][73] Esta solución pode evaporarse para producir cloruro de cesio ou transformarse ben en alume de cesio ou ben en carbonato de cesio.[4][74] Aínda que non é comercialmente factible, a redución directa do mineral con potasio, sodio ou calcio no baleiro pode producir metal de cesio de forma directa.[4][75]

Outro método alternativo para obter metal de cesio é a partir dos compostos purificados derivados do mineral. O cloruro de cesio, así como os outros haluros, pode reducirse a unha temperatura de entre 700 °C (973 K) e 800 °C (1070 K) con calcio ou bario, para posteriormente aplicar un proceso de destilación do metal de cesio. De forma semellante, os compostos con aluminio, carbono e hidróxido poden reducirse con magnesio.[4] O metal pode illarse tamén por medio da electrólise de cesio fusionado con cianuro (CsCN). Un tipo de cesio excepcionalmente puro e libre de gases pode producirse por descomposición termal de azida de cesio CsN
3 a unha temperatura de 390 °C (663 K), composto que á súa vez se obtén a partir de sulfato acuoso de cesio e azida de bario.[71]
En aplicacións de baleiro pode facerse reaccionar dicromato de cesio con circonio para formar metal de cesio puro libre doutros produtos gasosos:[76]
- Cs
2Cr
2O
7 + 2 Zr → 2 Cs + 2 ZrO
2+ Cr
2O
3
A gran maioría do cesio producido en extraccións mineiras en forma de sales convértese en formiato de cesio (HCOO−Cs+) para aplicacións na extracción de petróleo. A empresa Cabot Corporation construíu unha planta produtiva no ano 1997 na localización da mina Tanco, preto de Bernic Lake en Manitoba (Canadá), cunha capacidade produtiva de 1900 m3 de solución de formiato de cesio ao ano.[77] Os principais compostos comerciais a menor escala do cesio son o cloruro de cesio e o nitrato de cesio.[76] O prezo do cesio puro (en base metálica) cunha concentración de 99,8% era duns 10$ por gramo no ano 2009, mentres que os seus diversos compostos tiñan un prezo significativamente máis baixo.[25]
Aplicacións
Exploracións petrolíferas
O uso maioritario do cesio non radioactivo é en forma de formiato de cesio aplicado en fluídos de perforación para a industria petrolífera.[4] As solucións acuosas de formiato de cesio (HCOO−Cs+), obtidas ao facer reaccionar hidróxido de cesio con ácido fórmico, desenvolvéronse a mediados dos anos 1990 para o seu uso nos pozos petrolíferos. A función destes fluídos de perforación é a de lubricar as barrenas, desprazar os anacos de rochas cara á superficie e manter a presión na formación rochosa durante e despois da perforación do pozo.[4]
A alta densidade da solución salina de formiato de cesio (ata 2,3 g·cm−3)[78] e a natureza relativamente benigna da maioría dos compostos de cesio reducen o número de sólidos tóxicos de alta densidade nestes fluídos, supoñendo unha vantaxe tecnolóxica e medioambiental.[78] A solución de formiato de cesio pode mesturarse con formiatos de potasio e sodio para reducir a densidade do fluído ata igualar a da auga (1,0 g·cm−3). A maiores disto é biodegradable e reciclable, factor comercial importante para o seu uso debido ao custo deste produto (4000 $ por barril no ano 2001).[79] Os formiatos dos elementos alcalinos non presentan perigos no seu manexo e non resultan tan corrosivos como outras solucións salinas alternativas de alta densidade, como por exemplo solucións de bromuro de cinc (ZnBr
2), ademais de supoñer un menor custo de limpeza e eliminación que estas alternativas.[4]
Reloxos atómicos

Os reloxos atómicos baseados no cesio observan as transicións electromagnéticas na estrutura hiperfina dos átomos de cesio-133 e empréganas como punto de referencia. O primeiro reloxo de cesio preciso construíuno Louis Essen no ano 1955 no National Physical Laboratory do Reino Unido.[80] Dende entón foron mellorados progresivamente, chegando a formar a base dos estándares de medidas do tempo e da frecuencia pola súa gran precisión.[69] O erro na medición de frecuencias destes reloxos é de 2 a 3 partes en 1014, o que corresponde a unha precisión na medida do tempo de 2 nanosegundos por día, ou un segundo en 1,4 millóns de anos. As versións máis recentes poden acadar unha precisión algo mellor que 1 parte en 1015, o que significa que o erro na medición é de 1 segundo en 20 millóns de anos.[4] Os reloxos de cesio tamén se empregan en redes de control para os tempos das transmisións de móbiles e do tráfico de información en Internet.[81]
Electricidade e electrónica
Os xeradores termoiónicos de vapor de cesio son dispositivos que converten a enerxía térmica en enerxía eléctrica. Nos convertedores de tubos de baleiro de dous eléctrodos este vapor de cesio neutraliza a carga espacial que se acumula preto do cátodo, mellorando desta forma o fluxo da corrente.[82]
O cesio tamén resulta de importancia grazas ás súas propiedades fotoeléctricas de conversión de enerxía lumínica en fluxos de electróns. Emprégase en células fotoeléctricas debido a que os cátodos baseados en cesio, como o composto intermetálico K
2CsSb, teñen un límite de voltaxe baixo para a emisión de electróns.[83] Os distintos tipos de dispositivos que poden empregar cesio son dispositivos de recoñecemento óptico de caracteres, fotomultiplicadores, e tubos de videocámaras.[84][85] Outros elementos como o xermanio, o rubidio, o selenio, o silicio ou o telurio poden substituír o cesio nestes materiais fotosensitivos.[4]
Os cristais de ioduro de cesio (CsI), bromuro de cesio (CsBr) e fluoruro de cesio (CsF) empréganse en contadores de escintilación de uso estendido na exploración mineral e nas investigacións da física de partículas, grazas ás capacidades para a detección de raios gamma e radiación de raios X. O cesio, ao ser un elemento pesado, fornece un bo poder de parada e contribúe a mellorar a detección e o tempo de resposta destes aparellos.[72][86][87]
O vapor de cesio utilízase en moitos magnetómetros,[88] e o elemento emprégase como un estándar interno no campo da espectrofotometría.[89] Ao igual que outros metais alcalinos ten unha grande afinidade co osíxeno e emprégase como elemento que contribúe a manter o baleiro nos tubos de baleiro.[90] Outros usos do cesio nestes campos da ciencia inclúen aplicacións en láseres de grande enerxía, lámpadas fluorescentes e rectificadores de vapor.[4]
Fluídos de centrifugado

Debido á súa alta densidade, é habitual o uso de diversas solucións de cloruro de cesio, sulfato de cesio e triofluoroacetato de cesio (Cs(O
2CCF
3)) na bioloxía molecular para o ultracentrifugado de gradientes de densidades.[72] Esta tecnoloxía aplícase principalmente no illamento de partículas virais, orgánulos subcelulares e ácidos nucleicos a partir de mostras biolóxicas.[91]
Usos na química e na medicina
As aplicacións químicas do cesio son relativamente reducidas en comparación a outros elementos.[71] A dopaxe con compostos de cesio realízase para mellorar a efectividade de varios catalizadores de metal-ións empregados na produción de substancias químicas como o ácido acrílico, a antraquinona, o óxido de etileno, o metanol, o anhídrido ftálico, o estireno, monómeros de metacrilato de metilo e varios alquenos. Tamén se usa na conversión catalítica de dióxido de xofre en trióxido de xofre durante o proceso de produción de ácido sulfúrico.[4]
O fluoruro de cesio ten un uso especializado na química orgánica como base[15] e como fonte anhídrica de ión fluoruro,[92] mentres que os sales de cesio poden substituír as de potasio ou sodio na síntese orgánica en procesos de ciclicación, esterificación e polimerización.[93][94][95] O cesio tamén se emprega na dosimetría de radiación termoluminiscente (TLD). Ao expoñerse a radiación adquire defectos cristalinos que ao quentarse retornan unha emisión de luz proporcional á dose recibida. Medir este pulso de luz cun tubo fotomultiplicador permite cuantificar a dose de radiación acumulada.[96][97][98]
Os sales de cesio foron avaliadas como reaxentes antishock para o seu uso trala administración de medicamentos con base de arsénico, aínda que o seu uso é máis limitado que os sales de rubidio ou potasio debido ao seu efecto no ritmo cardíaco.[4][99] Estes sales tamén teñen sido probados para o tratamento da epilepsia e de convulsións.[100][101]
Aplicacións nucleares e dos isótopos de cesio
O cesio-137 é un radioisótopo de uso común como emisor de raios gamma en aplicacións industriais. As vantaxes deste isótopo son a súa vida media de case 30 anos, a dispoñibilidade do mesmo a partir do ciclo do combustible nuclear e o feito de que teña o 137Ba como produto estable final. Por outra banda, a súa alta solubilidade en auga é unha desvantaxe que o fai incompatible con irradiadores para a produción de subministración de comida e medicinas.[102] Tense empregado na agricultura, en tratamentos médicos para o cancro e na esterilización de comida, lodos de sumidoiros e equipo cirúrxico.[4][103] Os isótopos radioactivos de cesio empregáronse en radioterapia para tratar certos tipos de cancro,[104] pero a aparición de alternativas mellores e o risco de contaminación por mor do uso de cloruro de cesio soluble en auga provocaron que estes usos do cesio se desbotasen progresivamente.[105][106] O cesio-137 aplícase en diversos calibres de medición industrial para a humidade, densidade, nivel e viscosidade.[107] Tamén se emprega en rexistros de perforación para medir a densidade de electróns das formacións rochosas.[108]
O isótopo 137 ten diversas aplicacións en estudos hidrolóxicos.[109] Sendo un produto das reaccións nucleares de fisión, por mor das probas nucleares comezadas en 1945 ata a década dos anos 1980 este isótopo foi liberado na atmosfera, onde se absorbeu rapidamente en forma de solución.[110] As variacións anuais coñecidas durante ese período permiten a súa correlación co solo e as capas de sedimentación.[111] Outros isótopos menos habituais como o cesio-134 e, en menor medida, o cesio-135, poden empregarse na hidroloxía para medir as emisións de cesio producidas pola industria da enerxía nuclear.[112][113][114]
Outros usos

O cesio e o mercurio foron empregados como propelente nalgúns primeiros deseños de motores iónicos para propulsión aeroespacial en misións interplanetarias de longa duración. O método de ionización consistía en extraer o electrón exterior do propelente ao entrar en contacto cun eléctrodo de volframio ao que se lle aplicaba unha voltaxe. Porén, as preocupacións pola acción corrosiva do cesio en compoñentes de naves espaciais dirixiron o desenvolvemento na dirección de uso de gases inertes como propelentes no lugar deste elemento. Estes gases resultan máis doados de manexar nas probas en terra e teñen un menor potencial de interferencia coa nave espacial que o cesio.[4] Eventualmente o xenon sería o elemento empregado na nave experimental Deep Space 1, lanzada no ano 1998.[115][116] Malia todo iso, téñense construído motores de propulsión de emisión de campos eléctricos que empregan un sistema simple de aceleración de ións de metal líquido como o do cesio para crear o pulo.[117]
O nitrato de cesio pode usarse como oxidante e colorante pirotécnico para a combustión de silicio en bengalas infravermellas,[118] como por exemplo na denominada LUU-19,[119] xa que este elemento emite unha gran maioría da súa luminosidade no espectro infravermello.[120] O cesio tamén se usou para reducir a sinatura de radar dos gases de escape do avión militar Lockheed SR-71 Blackbird,[121] e xunto co rubidio tense engadido en forma de carbonato ao vidro para reducir a condutividade eléctrica e mellorar a estabilidade e durabilidade da fibra óptica e dos dispositivos de visión nocturna.[4]
Diversas investigacións sobre sistemas magnetohidrodinámicos de xeración de enerxía tiveron lugar, pero non conseguiron unha aceptación xeral da comunidade científica,[122] e o metal de cesio considerouse tamén como fluído de traballo en xeradores turboeléctricos de altas temperaturas do ciclo Rankine.[123]
Precaucións

Os compostos de cesio non radioactivos considéranse medianamente tóxicos. A exposición a grandes cantidades destes compostos pode causar irritabilidade e espasmos debido ás semellanzas químicas do cesio co potasio. Porén, estas grandes cantidades non se atopan nas fontes naturais do elemento e o cesio non radioactivo non se considera un perigo significante para o medio ambiente.[125] A dose letal media (DL50) do cloruro de cesio en ratos é de 2,3 g por quilogramo, valor semellante ao das DL50 do cloruro de potasio e do cloruro de sodio.[126] O principal uso do cesio non radioactivo en forma de formiato de cesio como fluído para as perforacións petrolíferas presenta unha vantaxe na súa baixa toxicidade fronte a outras alternativas de menor custo económico.[78]
O metal de cesio é un dos elementos máis reactivos, altamente explosivo ao entrar en contacto coa auga. O gas de hidróxeno producido por esta reacción quéntase por medio da enerxía térmica liberada de forma simultánea, causando unha ignición e unha explosión violenta. Isto tamén pode suceder con outros metais alcalinos, pero o cesio en particular é tan potente que pode dar lugar a esta reacción explosiva incluso con auga fría.[4] A temperatura de autoignición do cesio é de −116 °C, o que fai que sexa moi pirofórico e poida comezar unha ignición no aire formando hidróxido de cesio e varios óxidos.[9][127] O hidróxido de cesio é unha base moi forte que provoca unha corrosión moi rápida no vidro.[128]
Os isótopos 134 e 137 atópanse na biosfera en pequenas cantidades produto de diversas actividades do ser humano, e representan unha carga radioactiva que varía segundo a localización. O cesio radioactivo non se acumula no corpo humano de forma tan efectiva como outros produtos de fisión como poden ser o iodo e o estroncio. Ao redor dun 10% do cesio radioactivo absorbido expúlsase relativamente rápido en forma de suor e nos ouriños, mentres que o 90% restante ten unha vida biolóxica media de entre 50 e 150 días.[129] O cesio radioactivo tende a acumularse rapidamente nos tecidos das plantas, así como nas froitas e verduras.[130][131][132] As distintas plantas absorben o cesio de diferentes maneiras. Algunhas absorben pequenas cantidades, mentres que outras absorben grandes cantidades e presentan unha gran resistencia aos seus efectos. Os fungos de bosques contaminados tamén acumulan o cesio radioactivo (137Cs) nos seus esporocarpos.[132][133] A acumulación de cesio-137 en lagos e outros corpos de auga semellantes pasou a ser unha preocupación medioambiental mundial dende o accidente de Chernóbil.[134][135] Os resultados dunha serie de experimentos con cans amosaron que unha única dose de 3,8 milicurios por quilogramo provoca a morte en tres semanas,[136] mentres que cantidades máis pequenas poden causar infertilidade e cancro.[137] A Axencia Internacional de Enerxía Atómica e outras fontes teñen alertado da posibilidade do uso de cesio-137 xunto a outros materiais radioactivos en dispositivos de dispersión radiolóxica.[138]
Accidentes significativos
O accidente radiolóxico de Goiânia foi un evento de contaminación radioactiva que tivo lugar o 13 de setembro de 1987 en Goiânia, a capital do estado brasileiro de Goiás. Unha vella fonte de radioterapia foi roubada nun hospital abandonado na cidade, e posteriormente pasou polas mans dunha multitude de persoas, resultando na morte de catro delas. Aproximadamente 112 000 persoas sometéronse a un exame para detectar contaminación radioactiva, e 249 delas presentaron niveis significativos de material radioactivo no seu corpo.[139][140]
No ano 1998 a fábrica de Acerinox en Los Barrios (Cádiz) fundíu unha cápsula de cesio-137 que se atopaba nunha consigna de ferralla.[141][142] As substancias radioactiva liberáronse na atmosfera e estendéronse por toda Euorpa. As autoridades nucleares de Francia, Alemaña, Italia e Suíza detectaron ata 2400 μBq de radiación ionizante no aire, un valor 1000 veces maior do normal.[143] Outras dúas factorías en Huelva e Badaxoz tiveron tamén contaminación debido aos residuos que se transportaron alí dende a fábrica de Acerinox,[142] e durante o proceseo de limpeza botáronse unhas 7000 toneladas de residuos radioactivos nas marismas de Mendaña, en Huelva.[144] Os custos totais deste accidente estimáronse nuns 18 millóns de euros por mór da perda de produción na factoría, 3 millóns de euros para a limpeza e outros 3 millóns de euros para o almacenamento dos residuos.[141]
Notas
- Referencias
Todas as referencias en inglés agás cando se indique o contrario.
Véxase tamén
Bibliografía
- "Táboa periódica dos elementos" (PDF). Consello da Cultura Galega, Xunta de Galicia, Real Academia Galega de Ciencias, Real Academia Galega e Ciencia Nosa. 2019.
- Bermejo, M. R.; González, A.; Vázquez, M. (2006). O nome e o símbolo dos elementos químicos (PDF). Xunta, Secretaría Xeral de Política Lingüística e CRPIH. ISBN 978-84-453-4325-8.
- Bermejo, M. R.; González, A.; Maneiro, M. (2018). Guía dos elementos químicos. Historia, propiedades e aplicacións. Xunta de Galicia e CRPIH. ISBN 978-84-453-5297-7.
Ligazóns externas
- Steck, Daniel A. (2 de maio de 2008). "Cesium D Line Data" (PDF) (en inglés). Revisión 2.0.1.
- "Toxic Substances Portal - Cesium". Agency for Toxic Substances and Disease Registry (en inglés).