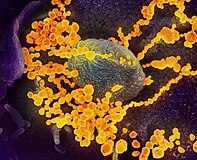
SARS-CoV-2
Drugi koronawirus ciężkiego ostrego zespołu oddechowego, SARS-CoV-2 (ang. severe acute respiratory syndrome coronavirus 2)[a][1][2] – wirus należący do grupy koronawirusów, z pojedynczą nicią o dodatniej polaryzacji ssRNA(+)[3], który wywołuje ostrą chorobę układu oddechowego COVID-19. Jest to jeden z siedmiu znanych chorobotwórczych dla ludzi gatunków z tej grupy wirusów[4].
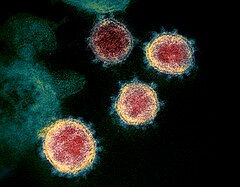 Wirus SARS-CoV-2 (obraz z mikroskopu elektronowego) | |
| Systematyka | |
| Grupa | Grupa IV ((+)ssRNA) |
|---|---|
| Rząd | nidowirusy |
| Rodzina | Coronaviridae |
| Rodzaj | beta-koronawirusy |
| Cechy wiralne | |
| Skrót | SARS-CoV-2 |
| Kwas nukleinowy | RNA |
| Nagi kwas nukleinowy | Tak |
| Rezerwuar | |
| Wywoływane choroby | |
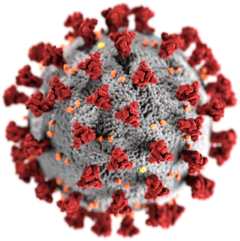
Pierwsze przypadki zakażeń ludzi tym wirusem odnotowano pod koniec 2019 roku w mieście Wuhan we wschodnich Chinach[5][6]. Wirus przenosi się drogą kropelkową, a u niektórych chorych wywołuje ciężkie zapalenie płuc i zespół ostrej niewydolności oddechowej, wymagające zastosowania wentylacji mechanicznej[7][8].
Warianty SARS-CoV-2
Ludzki koronawirus SARS-CoV-2[9][10][11] (początkowo 2019-nCoV, zidentyfikowany w Wuhanie) należy do podgrupy A beta-koronawirusów (β-koronawirusów)[12]. Światowa Organizacja Zdrowia (WHO) wprowadziła nazwy wariantów koronawirusa SARS-CoV-2 pochodzące od liter greckiego alfabetu, w miejsce używanych wcześniej.
Warianty uznawane przez WHO za budzące obawę (VoC, ang. variants of concern) mają nazwy[13]:
- alfa (wariant B.1.1.7[14], wariant brytyjski)[13],
- beta (wariant B.1.351, B.1.351.2, B.1.351.3[14], wariant południowoafrykański)[13][15],
- gamma (P.1, P.1.1, P.1.2[14], wariant brazylijski)[13][15],
- delta (wariant B.1.617.2, AY.1, AY.2, AY.3[14], wariant indyjski)[13][15],
- mu[16] (wariant B.1.621[17], wariant kolumbijski)[18]
Warianty budzące zainteresowanie (VoI, ang. variants of interest) są opisywane kolejnymi literami greckiego alfabetu:
- eta (wariant B.1.525[14], wariant nigeryjski)[13][15],
- iota (wariant z USA, B.1.526)[17],
- kappa (wariant indyjski, B.1.617.1)[17],
- lambda (wariant C.37, wariant peruwiański)[17].
Ponadto warianty epsilon (B.1.427/B.1.429[17], wariant kalifornijski[13]), zeta (P.2[17], wariant brazylijski)[15] i theta (P.3[17], wariant filipiński[15]) początkowo klasyfikowano jako warianty budzące zainteresowanie, a następnie przesunięto je do kategorii zagrożeń do dalszego monitorowania[17].
Odkrycie
Zachorowania powodowane niezidentyfikowanym wirusem rozpoczęły się w listopadzie 2019[19]. Pierwsze zakażenie miało miejsce 17 listopada 2019; zarażonym był 55-letni mężczyzna z Wuhanu[20][21]. Niedługo odnotowano grupę pacjentów cierpiących na zapalenie płuc nieznanej etiologii. Zachorowania te władze Chin powiązały z miejscem sprzedaży owoców morza w Wuhanie, w chińskiej prowincji Hubei[4], gdzie handlowano też żywymi zwierzętami[22]. Ostatniego dnia roku Chińskie Centrum Kontroli i Prewencji Chorób (CCDC, od ang. Chinese Center for Disease Control and Prevention; chiń. 中国疾病预防控制中心) wysłało do Wuhanu zespół mający wspomóc władze lokalne, który przeprowadził dochodzenie epidemiologiczne mające ukazać przyczynę zachorowań[4]. Dochodzenie to wykluczyło koronawirusy powodujące SARS i MERS, wirusy wywołujące grypę ludzką i ptasią, a także inne popularne wirusy powodujące infekcje dróg oddechowych[22]. 7 stycznia 2020 władze Chin potwierdziły, że zachorowania powoduje nowy wirus z grupy koronawirusów, nazwany roboczo 2019-nCoV[23]. Pięć dni później wirusolodzy dysponowali już jego zsekwencjonowanym genomem[22]. W nabłonku dróg oddechowych trzech pacjentów wykryto (po czym wyizolowano) wirusa, którego genom cechował się dużym podobieństwem (identyczne w 85%) do beta-koronawirusów linii B wykrywanych wcześniej u nietoperzy – bat SARS-like CoV (bat-SL-CoVZC45, MG772933.1)[4][24].
Pochodzenie
Według oficjalnych informacji władz Chin źródłem, z którego wirus mógł się rozprzestrzenić, był targ rybny Huanan[25][26], gdzie sprzedawane były zarówno dzikie zwierzęta, jak i owoce morza[27][28][29]. Pojawiły się jednak zarzuty o braku pełnej informacji, także zarzut zniszczenia pierwotnych próbek, co spowodowało, że pochodzenie wirusa jest nadal przedmiotem dyskusji (zobacz: Hipoteza wycieku laboratoryjnego COVID-19).
Budowa molekularna

SARS-CoV-2 jest wirusem osłonkowym, którego genom stanowi jednoniciowe RNA o polarności dodatniej[30]. Każdy wirion SARS-CoV-2 ma kształt zasadniczo kulisty, choć nieco pleomorficzny, o średnicy 60–140 nm. Otoczony jest wyraźnymi wypustkami (ang. spikes) o długości 9–12 nm, nadającymi mu wygląd podobny do korony słonecznej[4]. Na dzień 13 marca 2020 roku przeprowadzono przynajmniej 75 kompletnych analiz genomu izolatów wirusa SARS-CoV-2[31]. Długość genomu wynosi od 29867 do 29903 nukleotydów[31] (dokładna liczba zależy od źródła i wynosi przykładowo 29891[30] lub 29903[32]), co czyni go, podobnie jak w przypadku innych koronawirusów, jednym z największych wirusów RNA, zarówno pod względem długości genomu, jak i rozmiaru wirionu[33].
Genom SARS-CoV-2 koduje białka niestrukturalne (ang. nonstructural proteins lub nsp; potrzebne do replikacji), strukturalne oraz pomocnicze (ang. accessory proteins)[34][35][36]. Podobnie jak inne koronawirusy, SARS-CoV-2 ma cztery białka strukturalne[33][37]:
- S (ang. spike) – białko fuzyjne lub glikoproteina powierzchniowa – odpowiedzialne za interakcję z receptorem na powierzchni komórek
- E (ang. envelope) – białko płaszcza – odpowiedzialne m.in. za formowanie wirionów
- M (ang. membrane) – białko błonowe lub membranowe – główne białko macierzy wirusa
- N (ang. nucleocapsid) – białko nukleokapsydu – pełniące funkcję ochronną dla dużej cząsteczki RNA oraz uczestniczące w modyfikacji procesów komórkowych i replikacji wirusa.
Białko N utrzymuje genom RNA, a białka S, E i M tworzą razem otoczkę wirusa. Białko S jest odpowiedzialne za łączenie z błoną komórki będącej gospodarzem[37]. Glikoproteinę S funkcjonalnie różnicuje się na podjednostki S1 i S2. Podjednostka S1 pośredniczy w wiązaniu z receptorem powierzchniowym komórki gospodarza, a podjednostka S2 pośredniczy w fuzji z jej błoną komórkową i następnie wirus dostaje się do komórki poprzez endocytozę[38].
Porównanie białka S genomu SARS-CoV-2 z dwoma innymi izolatami wirusów pochodzących od nietoperzy: bat-SL-CoVZC45 i bat-SL-CoVZXC21 pokazuje niską, 75% zgodność. Szczególnie duże różnice wykazuje sekwencja nukleotydowa kodująca podjednostkę S1 w SARS-CoV-2 (zgodność w 68%), co czyni ją bardziej zbliżoną do odpowiedniej sekwencji nukleotydowej SARS-CoV. Można na tej podstawie wywnioskować, że SARS-CoV i nowy koronawirus wykorzystują ten sam receptor komórkowy, enzym konwertazy angiotensyny 2 (ACE2)[38]. Zostało to udowodnione eksperymentalnie, jak opisano w dalszej sekcji patogeneza.
W porównaniu z SARS zaobserwowano obecność czterech dodatkowych insercji reszt aminokwasowych na granicy pomiędzy podjednostkami S1 i S2[39].

| Identyfikator genomu NCBI | MN985325 |
|---|---|
| Rozmiar genomu | 29882 zasady |
| Nazwa izolatu | 2019-nCoV/USA-WA1/2020 |
| Data opublikowania | 24.01.2020 |
| Proteina | Masa atomowa [kDa] | Podobieństwo do SARS-CoV [%] | Opis funkcji |
|---|---|---|---|
| Nsp1 | 19,8 | 91,1 | Tłumienie odpowiedzi przeciwwirusowej w organizmie gospodarza |
| Nsp2 | 70,5 | 82,9 | |
| Nsp3 | 217,3 | 86,5 | Kompleks białek Nsp3-Nsp4-Nsp6 bierze udział w replikacji wirusa |
| Nsp4 | 56,2 | 90,8 | Kompleks białek Nsp3-Nsp4-Nsp6 bierze udział w replikacji wirusa |
| Nsp5 | 33,8 | 98,7 | Główna proteaza (Mpro lub 3CLpro) |
| Nsp6 | 33,0 | 94,8 | Kompleks białek Nsp3-Nsp4-Nsp6 bierze udział w replikacji wirusa |
| Nsp7 | 9,2 | 100,0 | Kompleks białek Nsp7-Nsp8 jest częścią polimerazy RNA |
| Nsp8 | 21,9 | 99,0 | Kompleks białek Nsp7-Nsp8 jest częścią polimerazy RNA |
| Nsp9 | 12,4 | 98,2 | Wiązanie ssRNA |
| Nsp10 | 14,8 | 99,3 | Istotne dla aktywności metylotransferazy Nsp16 |
| Nsp11 | 1,3 | 92,3 | Peptyd krótki |
| Nsp12 | 106,7 | 98,3 | Polimeraza RNA |
| Nsp13 | 66,9 | 100,0 | Helikaza/trifosfataza |
| Nsp14 | 59,8 | 98,7 | Egzonukleaza typu 3'→5' |
| Nsp15 | 38,8 | 95,7 | Endorybonukleaza specyficzna wobec urydyny |
| Nsp16 | 33,3 | 98,0 | Metylotransferaza czapeczki RNA |
| S | 141,2 | 87,0 | Białko fuzyjne, pośredniczy w fuzji z receptorem powierzchniowym |
| Orf3a | 31,1 | 85,1 | Aktywuje inflamasom NLRP3 |
| Orf3b | 6,5 | 9,5 | |
| E | 8,4 | 96,1 | Białko płaszcza, biorące udział w morfogenezie i składaniu filamentów wirusowych |
| M | 25,1 | 96,4 | Białko błonowe, dominujący składnik otoczki |
| Orf6 | 7,3 | 85,7 | Antagonista IFN typu I |
| Orf7a | 13,7 | 90,2 | Wywołuje indukowaną przez wirusa apoptozę |
| Orf7b | 5,2 | 84,1 | |
| Orf8 | 13,8 | 45,3 | |
| N | 45,6 | 94,3 | Białko (fosfoproteina) nukleokapsydu, związane z genomem RNA wirusa |
| Orf9b | 10,8 | 84,7 | Antagonista IFN typu I |
| Orf9c | 8,0 | 78,1 | |
| Orf10 | 4,4 | – |
Filogenetyka
Sekwencje koronawirusa SARS-CoV-2 wykazują podobieństwa do beta-koronawirusów znalezionych u nietoperzy[42]. Wirus ten jest jednak genetycznie odmienny od innych koronawirusów, jak koronawirus związany z SARS i koronawirus związany z MERS[43].
Wyizolowano i opisano pięć genomów nowego koronawirusa, w tym[44]:
- BetaCoV/Wuhan/IVDC-HB-01/2019
- BetaCoV/Wuhan/IVDC-HB-04/2020
- BetaCoV/Wuhan/IVDC-HB-05/2019
- BetaCoV/Wuhan/WIV04/2019
- BetaCoV/Wuhan/IPBCAMS-WH-01/2019.
| Identyfikator genomu NCBI | MN908947 |
|---|---|
| Rozmiar genomu | 30473 zasady |
| Rok ukończenia | 2020 |
Zalecany stopień bezpieczeństwa biologicznego (BSL) podczas prac z wirusem
Wirus SARS-CoV-2 został zakwalifikowany do grupy 3 ryzyka mikrobiologicznego.
Światowa Organizacja Zdrowia zaleca przeprowadzanie prac z wirusem, który może się namnażać (na przykład hodowli wirusów, izolacji wirusów, testów neutralizacji) w laboratoriach o minimum 3 stopniu bezpieczeństwa biologicznego z przepływem powietrza ukierunkowanym do wewnątrz (BSL-3).
Z kolei laboratoryjne prace diagnostyczne z preparatami inaktywowanymi (bez możliwości replikacji wirusa), takie jak na przykład sekwencjonowanie białek wirusa lub testy molekularne amplifikacji kwasów nukleinowych (NAAT) powinny być przeprowadzane w laboratoriach o minimum 2 stopniu bezpieczeństwa biologicznego (BSL-2)[45][46].
Diagnostyka
Objawy infekcji

Opisano serię przypadków osób zainfekowanych wirusem w Chinach. Pacjenci zgłaszali gorączkę i kaszel. Po czterech dniach u jednego z nich kaszel się nasilił, za to gorączka spadła. Z pierwszych trzech opisanych przypadków dwóch wyzdrowiało, stan jednego się pogorszył. Doszło do konieczności użycia wentylacji mechanicznej; leczenie zakończyło się zgonem[4].
Badania krwi często wykazywały małą liczbę białych krwinek (leukopenia i limfopenia)[22].
Wirulencja i patogeneza
W porównaniu z wirusami SARS i MERS wirus SARS-CoV-2 jest mniej wirulentny ze znacznie mniejszym wskaźnikiem śmiertelności, za to dużo bardziej zakaźny. Eliminacja nowego wirusa następuje najprawdopodobniej szybciej niż SARS i MERS, chociaż dane dotyczące przypadków krytycznych są w tym kontekście niejednoznaczne[47][48].
Charakterystyka zakażeń wywoływanych przez wirus SARS-CoV-2
Wirus SARS-CoV-2 może kolonizować i atakować[49][50][51][52][53][54][55][22][56][57][58][59][47]:
- układ oddechowy – powodując w ciężkich przypadkach ostre atypowe zapalenie płuc oraz zespół ostrej niewydolności oddechowej
- układ nerwowy – wywołując objawy neurologiczne, jak ból głowy, nudności, uczucie splątania, zaburzenia świadomości, a w ciężkich przypadkach choroby mózgowonaczyniowe. W przypadku wirusa SARS istnieją badania in vivo mówiące również o możliwości infekcji pnia mózgu[60]; pojawiły się również badania mówiące o utracie węchu i smaku spowodowanej atakowaniem receptorów węchowych i smakowych przez wirus[61].
- układ pokarmowy – powodując między innymi biegunkę i wymioty. Badania wykazały obecność wirusa w kale.
- układ moczowy – wywołując powikłania, w tym ostre uszkodzenie nerek. Badania wykazały obecność wirusa w moczu pacjentów.
- układ krwionośny – przyczyniając się do ostrej niewydolności serca.
Wirus może indukować nadmierną odpowiedź immunologiczną organizmu, co przejawia się zwiększeniem poziomów cytokin IL2, IL7, IL10, G-CSF, IP10, MCP1, MIP1A i TNFα[62]. Zobacz również sekcję immunopatologia.
W skrajnych przypadkach SARS-CoV-2 może doprowadzić do infekcji ogólnoustrojowej (sepsy), a RNA wirusa dostać się do krwi (wiremia).
Infekcja wirusem jest niespecyficzna i może przebiegać bezobjawowo lub z łagodnymi objawami, a pierwotnym szlakiem zakażenia jest najczęściej układ oddechowy. Czynniki kolonizacji nie są jednak do końca poznane[63][64].
Drogi szerzenia infekcji
Przenoszenie wirusa z człowieka na człowieka
20 stycznia 2020 r. Narodowa Komisja Zdrowia Chin ogłosiła, że możliwe jest przekazywanie wirusa z człowieka na człowieka[65][66], zwłaszcza gdy dwie osoby są ze sobą w bliskim kontakcie (odległość mniejsza niż 1,8 m[67] lub odległość mniejsza niż 1–2 m[68]). Uważa się, że rozprzestrzenia się on podobnie jak inne patogeny chorób układu oddechowego drogą kropelkową[7][67][68][69]. Do tej pory wirus został wykryty w wydzielinie z nosa i gardła, w plwocinie, moczu, stolcu, cieczy łzowej i krwi[50][70][71][72].
Singapurscy naukowcy zalecają traktowanie kału jako zakaźnego w oparciu o wykrycie wirusa w kale oraz zakaźnego wirusa SARS-CoV w ściekach z dwóch chińskich szpitali podczas pandemii SARS 2002/2003. Aby wykluczyć możliwość infekcji fekalno-oralnej oprócz infekcji kropelkowej i inhalacyjnej[73]. W badaniu na niewielkiej grupie osób wykazano, że wysokie miano wirusa na tekstyliach i powierzchniach przedmiotów można wykryć w sypialniach i łazienkach osób zakażonych koronawirusem nawet metodą PCR. Ograniczeniem badania był brak hodowli wirusów w celu wykazania ich żywotności, zatem zakaźność nie została ostatecznie udowodniona, ale autorzy badania zakładają na podstawie swoich wstępnych wyników, że prawdopodobne jest przeniesienie wirusa przez zakażone przedmioty[74]. Nowsze badania SARS-CoV-2 wykazały obecność zakaźnych cząstek wirusa w kale i w moczu, co sugeruje możliwość jego replikacji w przewodzie pokarmowym i układzie moczowym[75][76]. Nie wiadomo jeszcze, czy inne płyny ustrojowe zarażonej osoby, w tym wymiociny, mleko matki lub sperma, mogą zawierać zakaźne wirusy[77].
Badania w Holandii ujawniły obecność wirusa w ściekach, co pozwala przypuszczać, że badania ścieków mogą umożliwić monitorowanie krążenia wirusa w populacji nawet przy niewielkiej liczbie przypadków[78].
Na podstawie analiz ilościowych badań RT-PCR nosowej części gardła (nasopharynx) chińscy naukowcy wywnioskowali, że wirus, podobnie jak grypa, może być przenoszony również drogą wziewną (powietrzną)[79][80]. U 17 badanych pacjentów z objawami choroby miano wirusa w nosie było wyższe niż w gardle, a występowanie szczególnie w górnych drogach oddechowych odróżnia SARS-CoV-2 od wirusa wywołującego SARS[79]. Testy pacjentów z obszaru Monachium nie wykazały wirulencji z próbek kału pomimo wykrycia RNA wirusa. Miano wirusa w nosogardzieli było jednak 1000 razy wyższe niż w znanych wcześniej chorobach wywołanych koronawirusami, takimi jak SARS i MERS[81]. Dowodzi to, że wirus replikuje się już w górnych drogach oddechowych, chociaż dopiero w głębszych obszarach płuc może wchodzić w fuzję z komórkami gospodarza i namnażać się poprzez wiązanie z receptorem błonowym ACE2 (konwertaza angiotensyny 2; kininaza II) dzięki domenie wiążącej receptor (ang. Receptor Binding Domain) zakodowanej w białku fuzyjnym S (ang. Spike) wirusa SARS-CoV-2. Rozszerzenie tropizmu tkankowego do obszarów gardła prowadzi do założenia, że wirus zawiera proteazę furynopodobną, która jest niezbędna na etapie cięcia enzymatycznego (ang. Cleaving) w celu wejścia do komórki gospodarza i następnie replikacji w niej[82][83][84].
W badaniu z udziałem dziewięciu pacjentek, które były zakażone SARS-CoV2 w ostatnim trymestrze ciąży, każde z dziewięciorga dzieci okazało się wolne od infekcji wirusem po urodzeniu przez cesarskie cięcie. Na tej podstawie autorzy badania stwierdzili, że wirus nie przenosi się w łonie matki[85]. Do 6 lutego 2020 roku chińskie instytucje zdrowia publicznego zarejestrowały tylko dziewięcioro niemowląt, u których wykazano obecność wirusa. Autorzy badania za możliwą przyczynę tej niewielkiej liczby wskazują stosunkowo dużą liczbę przypadków skąpoobjawowych wśród dzieci, a także niedostateczny system raportowania przypadków[86].
Wpływ warunków środowiskowych na transmisyjność wirusa
Nie jest jasne, czy transmisja wirusa odbywa się poprzez kontakt z zanieczyszczonymi powierzchniami i przedmiotami[67]. Analiza 22 badań dotyczących przeżywalności koronawirusów istotnych z medycznego punktu widzenia (takich jak SARS-CoV i MERS-CoV) na powierzchniach pokazuje, że wirusy te mogą utrzymywać się na powierzchniach materiałów wykonanych z metalu, szkła lub tworzywa sztucznego do dziewięciu dni w temperaturze pokojowej. Pozostają jednak zakaźne przez średnio cztery do pięciu dni, ale mogą być inaktywowane środkami dezynfekującymi. Według naukowców zaangażowanych we wspomniane badania odkrycia te można zastosować do SARS-CoV-2[87][88].
Temperatura wpływa na aktywność i przeżywalność wirusa SARS-CoV-2, który jest wysoce stabilny w temperaturze 4 °C i może w niej przetrwać znacznie dłużej niż 14 dni. W temperaturze pokojowej (22 °C) i wyższej przeżywalność wirusa nie przekracza 14 dni, a w temperaturze 70 °C czas inaktywacji wirusa to 5 minut. W temperaturze pokojowej wirus SARS-CoV-2 jest wyjątkowo stabilny w szerokim zakresie pH, wynoszącym od 3 do 10[89].
Biogeograficzne techniki modelowania nisz klimatycznych (SDM, ang. Species distribution modelling) zostały użyte do oszacowania warunków klimatycznych wyjaśniających w jak najlepszy sposób infekcje SARS-CoV-2. Wyniki badań wykazały, że – podobnie jak w przypadku SARS i MERS – czynniki klimatyczne mogą wpływać na dynamikę transmisji SARS-CoV-2. Według zastosowanych modeli klimaty umiarkowane ciepłe i chłodne bardziej sprzyjają rozprzestrzenianiu się wirusa, podczas gdy klimat regionów tropikalnych i równikowych oraz tereny suche – mniej. Chłodna i sucha pogoda jest bardziej odpowiednia do rozwoju wirusa, podczas gdy mniej odpowiednie są ekstremalne warunki temperaturowe: zimno, ciepło oraz wysoka wilgotność. Autorzy badania zauważają jednak, że czynniki klimatyczne są tylko jednym z wielu czynników mających wpływ na transmisyjność wirusa SARS-CoV-2[90].
Istnieją badania potwierdzające statystyczną korelację pomiędzy zanieczyszczeniami atmosferycznymi a rozprzestrzenianiem wirusa SARS-CoV-2, potwierdzające hipotezę, że podwyższone stężenie pyłów zawieszonych PM2,5 oraz PM10 może sprzyjać rozprzestrzenianiu wirusa, zaś podwyższone stężenie ozonu przyczynia się do ograniczenia aktywności SARS-CoV-2[91].
Mydło inaktywuje wirusa poprzez niszczenie jego otoczki lipidowej[92][93]. Potwierdzono również skuteczność środków dezynfekujących na bazie alkoholu w walce z SARS-CoV-2[94].
Badania transmisji wirusa na modelach zwierzęcych
Ponieważ SARS-CoV-2 jest uznawany za wirus odzwierzęcy, przypuszcza się, że możliwa jest transmisja pomiędzy niektórymi zwierzętami i ludźmi[7][8][95].
Światowa Organizacja Zdrowia stwierdziła, że nie ma wystarczających dowodów na to, że zwierzęta domowe, takie jak koty czy psy, mogą zarazić się koronawirusem[96].
Znany jest jednak pojedynczy przypadek z 28 lutego 2020 roku „lekko pozytywnego” wyniku testu na COVID-19 u psa w Hongkongu, przy czym w oświadczeniu wydanym przez Ministerstwo Rolnictwa, Rybołówstwa i Rezerwatów Przyrody Hongkongu (ang. Hong Kong Agriculture, Fisheries and Conservation Department) oświadczono o braku dowodów na możliwość infekcji COVID-19 u zwierząt domowych czy możliwości przeniesienia infekcji ze zwierzęcia domowego na człowieka[97].
Badania na modelach zwierzęcych z wykorzystaniem 14 zwierzęcych ortologów receptora ACE2 wykazały, że SARS-CoV-2 może wykorzystywać do wnikania komórkowego receptor ACE2 szerokiej gamy gatunków zwierząt. W przedstawionej tabeli usystematyzowano wyniki badań i uszeregowano badane gatunki zwierząt w szeregu od najbardziej do najmniej podatnych na infekcję wirusem[98].
| Gatunek | Podatność na infekcję w relacji do ludzkiego hACE2 |
|---|---|
| Makak królewski (Macaca mulatta) | Najwyższa (bliska ludzkiemu hACE2) |
| Królik europejski (Oryctolagus cuniculus) | |
| Pies domowy (Canis lupus familiaris) | |
| Łuskowiec jawajski (Manis javanica) | |
| Kot domowy (Felis catus) | >50% hACE2 |
| Molosek brazylijski (Tadarida brasiliensis) | |
| Jenot azjatycki (Nyctereutes procyonoides) | |
| Podkowiec chiński (Rhinolophus sinicus) | |
| Ryjonos piżmowy (Melogale moschata) | |
| Balizuar obrożny (Arctonyx collaris) | |
| Łaskun chiński (Paguma larvata) | |
| Mysz | <10% hACE2 |
| Szczur wędrowny (Rattus norvegicus) | Najniższa (prawie żadna) |
Powyższe wyniki mają istotne implikacje w kontekście zrozumienia potencjalnych naturalnych rezerwuarów wirusa, transmisji odzwierzęcej, transmisji z człowieka na zwierzęta oraz zastosowania modeli zwierzęcych w badaniach.
W odniesieniu do transmisji odzwierzęcej oraz pomiędzy zwierzętami na uwagę zasługuje dość wysoka podatność kotów i psów (powyżej 50% ludzkiego hACE2) na wejście wirusa z użyciem receptora ACE2, co stwarza teoretyczną możliwość infekcji człowieka przez zwierzęta domowe i vice versa. Wiadomo, że SARS-CoV-2 słabo namnaża się w organizmach psów, a lepiej w organizmach kotów. W badaniach serologicznych przeciwciał wobec SARS-CoV-2 u kotów z Wuhan po głównej fazie pandemii 14.7% kotów wykazało wynik pozytywny, co dowodzi, że wiele kotów zostało zainfekowanych, najprawdopodobniej z powodu bliskiego kontaktu z ludźmi. Mimo że aktualnie nie ma stanowczych dowodów, że zainfekowane zwierzęta domowe mogą przenosić wirusa na człowieka, ewentualność taka powinna zostać poddana dalszym badaniom.
W odniesieniu do modeli zwierzęcych powyższe wyniki wskazują na ograniczoną możliwość zastosowania w badaniach nad patogenezą wirusa, szczepionkami i leczeniem zwierząt takich jak myszy oraz szczury, które wykazują niewielką podatność na infekcję z użyciem receptora ACE2. Pewną ewentualnością są genetycznie modyfikowane myszy cechujące się ekspresją genów hACE2, jednak badacze proponują zastosowanie różnorodnych innych modeli zwierzęcych oraz potencjalną użyteczność królików w badaniach nad SARS i SARS-CoV-2[98].
Zaraźliwość
W modelach rozwoju epidemii kluczowym czynnikiem jest wskaźnik określający liczbę nowych infekcji pochodzących od jednego zakażonego, zwany bazowym współczynnikiem reprodukcji i oznaczany przez R0[99].
Raport Europejskiego Centrum Zapobiegania i Kontroli Chorób z 12 marca 2020 roku szacuje współczynnik reprodukcji na 2–3[100]. Różne raporty epidemiologiczne szacują wskaźnik nowych infekcji w zakresie 1,4 do 6,4[47][101][102][54][103][104].
Przyjęty w innym badaniu stochastyczny model dynamiki transmisji użyty do obliczenia współczynnika reprodukcji wirusa zależnego od czasu Rt sugeruje zmienność transmisji wirusa w czasie i jej zmniejszenie w wyniku wprowadzenia restrykcji w podróżach i ograniczeniu kontaktu pomiędzy ludźmi[105].
Zakaźność
Najważniejsze statystyki zakaźności przedstawiono poniżej:
- wirus może infekować wszystkie grupy populacji[66]
- mediana wieku wynosi 47 lat[64]
- wiek stanowi istotny czynnik prognostyczny zachorowalności; 80% stanowią osoby w wieku 15–59 lat, zachorowalność jest mniejsza wśród dzieci[64]
- płeć męska jest bardziej zagrożona wirusem, ok. 56% przypadków to mężczyźni[64]; wynik ten jest zgodny z charakterystyką wirusów SARS i MERS; naukowcy spekulują, że wynika to z roli hormonów oraz chromosomów i ich wpływu na odpowiedź immunologiczną[106][66]
- na ciężki przebieg infekcji wirusem SARS-CoV-2 narażeni są dorośli w każdym wieku[107].
Poniższe statystyki pokazują zakaźność wirusa według wieku i płci na podstawie łącznej liczby przypadków z Włoch, Hiszpanii i Chin według danych dostępnych na dzień 25 marca 2020 roku[108][109][110].
| Grupa wiekowa | 0-9 | 10-19 | 20-29 | 30-39 | 40-49 | 50-59 | 60-69 | 70-79 | 80+ |
|---|---|---|---|---|---|---|---|---|---|
| Udział zakażeń [%] | 0,7 | 0,9 | 5,7 | 11,1 | 15,4 | 20,0 | 18,1 | 15,2 | 12,8 |
Nie istnieje wiele badań koncentrujących się na przyczynach różnic w zachorowalności i śmiertelności wirusa u różnych płci i w różnych grupach wiekowych, które mogłyby wskazać, czy istotną rolę odgrywają cechy immunologiczne poszczególnych grup, czy cechy fenotypowe samego wirusa, a tym samym wskazać dalsze możliwości leczenia. Prace badawcze wykryły podwyższone miano wirusa u osób starszych, co może korelować z ciężkim przebiegiem choroby w tych grupach wiekowych. Część naukowców spekuluje, że może to być związane z podwyższoną ekspresją receptora ACE2 u starszych pacjentów[72].
Analiza kliniczna pacjentów pokazuje, że grupa krwi może wpływać na ryzyko infekcji COVID-19. Podobnie jak wykazywały wcześniejsze badania SARS w epidemii w 2019 roku[111], na podstawie wyników badań 2173 pacjentów chorych na COVID-19 z trzech szpitali w Wuhan i Shenzhen uważa się, że grupa krwi A zwiększa ryzyko choroby zakaźnej COVID-19, podczas gdy grupa krwi 0 je zmniejsza[112].
Zjadliwość i wskaźniki śmiertelności
Do marca 2020 roku z powodu zakażenia wirusem SARS-CoV-2 zmarło znacznie więcej osób niż z powodu zakażenia wirusami SARS i MERS łącznie. Mimo niższej śmiertelności w porównaniu z poprzednimi wirusami, na wynik ten wpływa wyższa zakaźność wirusa[113][47].
Światowa Organizacja Zdrowia, na podstawie danych zebranych do lutego 2020 roku głównie z Chin, oszacowała śmiertelność pandemii wywołanej wirusem SARS-CoV-2 na 3,4%[114][47].
Na uwagę zasługuje wyjątkowo niski wskaźnik śmiertelności dzieci poniżej 9 lat, a także wyższy wśród mężczyzn (4,7%) niż kobiet (2,8%)[115][116]. 22 marca 2020 roku poinformowano o pierwszej śmierci zakażonego niemowlęcia (Illinois)[117].
Mutageneza
Z perspektywy etiologii wirulencja patogenu czasami zwiększa się podczas przeskoku na nowego gospodarza. Inne badania pokazują natomiast, że wirulencja pasożytów zmniejsza się podczas długotrwałych interakcji pasożytów z jednym gospodarzem[118]. Koronawirusy mogą jednak dokonywać mutacji w celu lepszej adaptacji do organizmów ludzkich i zwiększenia wirulencji, tak jak to historycznie miało miejsce w latach 2002–2004 w przypadku SARS[119][120][121]. Drobne mutacje i rekombinacje są naturalne u koronawirusów i stanowią część ich naturalnego cyklu życiowego. Ponieważ wirusy te wykorzystują podatną na błędy replikacji RNA polimerazę, ich genom ma skłonność do gromadzenia mutacji podczas każdego cyklu kopiowania[120][122]. Naturalna selekcja odrzuca zmiany niekorzystne, a promuje zmiany, które dają wirusom korzyści ewolucyjne[121]. Z powyższych powodów istotne jest zrozumienie ryzyka mutacji wirusa SARS-CoV-2 i ich wpływu na wirulencję. Dostępne są wyniki wstępnych badań w tym zakresie[122][123][121][124][125][126][113].
W okresie od grudnia 2019 do lutego 2020 zaobserwowano 8 drobnych mutacji aminokwasów w badaniach 55 genomów, co jednak nie przełożyło się na duże zmiany funkcjonalne w zachowaniu wirusa SARS-CoV-2[121]. Alarmujące są zmiany w obrębie glikoproteiny S w położeniu 28144 (obszar genu ORF8)[122][121]. Inna analiza szczepów wirusa z różnych części świata opublikowana 17 marca 2020 roku wykazała mutacje w 10 z 244 badanych szczepów. Zaobserwowano zmiany w domenie wiążącej receptor białka S, co przypuszczalnie wiąże się z dalszą adaptacją wirusa do organizmów ludzkich[124][126]. Istnieją również dowody, że wirus SARS-CoV-2 ma już przynajmniej 3 podtypy genetyczne. W jednym z badań porównawczych 160 ludzkich sekwencji koronawirusa SARS-CoV-2 pozyskanych w okresie od grudnia 2019 do marca 2020 zawierało dokładnie 100 różnych szczepów filogenetycznych przy stosunkowo dużej dystrybucji geograficznej kladów, co sugeruje, że warianty mutacyjne mogą wpływać na obraz kliniczny i rozprzestrzenianie choroby w różnych krajach[127][128]. Badania pokazują też, że różne mutacje wykazują znaczącą zmienność w odniesieniu do wywoływanego efektu cytopatycznego oraz miana wirusa, co stanowi dowód na to, że SARS-CoV-2 może dokonywać mutacji powodujących znaczącą zmianę patogeniczności[129].

Inna analiza 220 kompletnych genomów z różnych części świata dostępnych w bazie danych GISAID datowanych na okres od grudnia 2019 do 13 marca 2020 pokazuje różne mutacje punktowe, wyraźnie rozróżnialne w różnych obszarach geograficznych – szczególnie od lutego 2020, kiedy zarejestrowano pierwsze przypadki lokalnej transmisji poza Azją. Na tle pozostałych mutacji szczególnie wyróżnia się mutacja RNA-zależnej polimerazy RNA (RdRp), zlokalizowana w położeniu 14408 i obecna w genomach na obszarze Europy po 20 lutego 2020. Polimeraza ta pełni istotną rolę w procesie replikacji wirusowego RNA. Wspomniana mutacja RdRp powiązana jest ze zwiększeniem liczby mutacji punktowych w porównaniu z genomami z Azji oraz jest uznawana przez naukowców za przyczyniającą się do zaburzenia aktywności korekcyjnej egzonukleazy wirusa. Mutacje w obszarze RdRp zaobserwowano również w innym badaniu 908 genomów z Ameryki Północnej. Wykres Częstość mutacji SARS-CoV-2 w różnych obszarach geograficznych pokazuje, że genomy wirusa od pacjentów z Europy i Ameryki Północnej prezentują zwiększoną częstość mutacji w porównaniu z genomami z Azji. Można również zaobserwować, że Europa i Ameryka Północna wykazują odmienne wzorce mutacyjne: mutacja 14408 (czerwona), 23403 (czarna), 28881 (ciemnoniebieska) i 26143 (jasnozielona) występują głównie w Europie, natomiast 18060 (różowa), 17857 (fioletowa) i 17746 (jasnoniebieska) są obecne głównie w Ameryce Północnej[130][131].
Prawdopodobieństwo mutacji znacząco zwiększa się w grupach o statystycznie mniejszym ryzyku infekcji, takich jak kobiety i osoby młode. Może to oznaczać, że nasilenie mutacji jest rezultatem zwiększonej konkurencyjności w interakcji wirus-organizm gospodarza, co zmusza wirusa do mutacji w celu uzyskania przewagi nad układem immunologicznym gospodarza[132].
Okres inkubacji
Okres inkubacji określa czas od zakażenia wirusem do momentu wystąpienia choroby i wynosi do 14 dni[64]. Istnieją pojedyncze dowody, że wirus jest zakaźny podczas inkubacji, co odróżniałoby go od SARS[81][133][134], chociaż nie ma ogólnej zgodności naukowców, jaka jest rola pacjentów asymptomatycznych i przed-symptomatycznych w transmisji wirusa[135][136][137]. Miano wirusa u pacjentów osiąga najwyższy poziom w pierwszym tygodniu choroby, a następnie stopniowo opada w drugim tygodniu, co sugerowałoby, że wczesne etapy choroby są najbardziej transmisyjne[72].
Patogeneza
Mechanizmy fuzji komórkowej i replikacji
Białko fuzyjne S wirusa (ang. Spike) odgrywa kluczową rolę w procesie wnikania wirusa do komórek gospodarza[138]. Podczas gdy glikoproteina S1 odpowiada za pierwszy etap wnikania wirusa do komórki, glikoproteina S2 może być wykorzystywana podczas drugiej fazy fuzji osłonki wirusa oraz komórki gospodarza[139]
Eksperymenty modelowania z użyciem białka S, bazujące na przewidywaniu struktury białek (ang. protein structure prediction), bardzo wcześnie sugerowały, że SARS-CoV-2 posiada odpowiednie powinowactwo do białka receptorowego ACE2 (enzymu konwertaza angiotensyny 2), które może zostać wykorzystane jako mechanizm wnikania do komórek gospodarza[140]. Do 22 stycznia 2020 r. grupa naukowców pracująca nad pełnym genomem wirusa w Chinach oraz grupa naukowców stosująca metody genetyki odwrotnej w Stanach Zjednoczonych wykazały niezależnie i eksperymentalnie, że ACE2 może działać jako receptor dla SARS-CoV-2[141][12][142][143][38]. Potwierdziły to dalsze prace[39][144]. Badania wykazały, że SARS-CoV-2 posiada większe powinowactwo do ludzkiego enzymu ACE2 niż wcześniejszy szczep wirusa SARS[145]. W eksperymencie z komórkami HeLa, które zawierały enzym ACE2 ludzi, nietoperzy z gatunku Rhinolophus sinicus, łaskunów, świń i myszy, SARS-CoV-2 był w stanie wykorzystać odpowiednie białko receptorowe ACE2 w celu wniknięcia do komórki. Wirus wyjątkowo nie był w stanie wykorzystać mysiego ACE2 ani łączyć się z komórkami HeLa, które nie tworzyły ACE2. Eksperyment wykazał również, że SARS-CoV-2 nie korzysta z innych receptorów typowych dla innych koronawirusów, takich jak aminopeptydaza N (APN) czy dipeptylopeptydaza IV (DPP4)[146]. Kolejne badania wykazały, że SARS-CoV-2 przedostaje się do komórek 293/hACE2 głównie poprzez endocytozę. Enzym PIKfyve, TPC2 i katepsyna L (lecz nie B) odgrywają krytyczną rolę w procesie ich połączenia[144].
ACE2 jest receptorem występującym tkankach płuc i innych narządów organizmu człowieka. Wykazano eksperymentalnie, że wirus może namnażać się nie tylko w obrębie płuc, ale również w komórkach nabłonka jelit (enterocytach), nerkach oraz naczyniach krwionośnych[147][148].

Badania wykazały, że pomimo silniejszego powinowactwa domeny wiążącej receptor (RBD) wirusa SARS-CoV-2 do wiązania z hACE2 w porównaniu z SARS, białko S SARS-CoV-2 nie wykazuje silniejszego powinowactwa do hACE2 niż białko S wirusa SARS. Wynika to z dynamicznych własności domeny RBD, która może przyjmować pozycję stojącą lub leżącą. Podczas gdy w SARS domena RBD jest zazwyczaj w pozycji stojącej, w przypadku SARS-CoV-2 znajduje się ona najczęściej w pozycji leżącej, co uniemożliwia wiązanie z receptorem gospodarza. Pozycja leżąca czyni domenę RBD mniej dostępną, co pozwala unikać nadzoru immunologicznego. Aby zachować wysoką zakaźność przy ograniczonej dostępności domeny RBD, wirus SARS-CoV-2 wykorzystuje drugą strategię: aktywację za pomocą proteaz organizmu gospodarza. Białko ACE2 nie jest jedynym receptorem, które wirus wykorzystuje do fuzji komórkowej[149].
Oprócz białka ACE2 istotnym czynnikiem patogenezy CoV-2 jest enzym seryna 2 (TMPRSS2), który obok ACE2 został przez naukowców uznany za kluczowy w procesie wnikania do komórek gospodarza. Proteaza TMPRSS2 aktywuje proces fuzji komórkowej z białkiem S wirusa SARS-CoV-2 oraz indukuje zależną od aktywności receptora formację syncytium. Mimo że trypsyna jest w stanie również aktywować glikoproteinę S i wyindukować dużą formację syncytium, wirus SARS-CoV-2 może najprawdopodobniej bez udziału trypsyny utworzyć syncytium niezależną od proteazy, lecz zależną od aktywności receptora[144]. Sugeruje się, że blokowanie TMPRSS2 może być kluczową strategią leczenia pacjentów z COVID-19[150][151][152].
Niezależne zespoły naukowców z Chin oraz Francji i Kanady, a w dalszej kolejności innych zespołów wykazały obecność pomiędzy podjednostkami S1 i S2 wirusa CoV-2 genów furynopodobnych[82][153][154][155][39][144]. Sugeruje to, że SARS-CoV-2 oprócz receptora ACE2 może wykorzystywać enzym furyny (ang. furin) do aktywacji procesu fuzji osłonki wirusa i komórek organizmu. Wspomniana mutacja genu w obrębie glikoproteiny S1/S2 nie jest obecna w betakoronawirusach linii B, lecz jest podobna do genów występujących w innych wirusach (HIV, Ebola) oraz betakoronawirusach linii A (HKU1, HCoV-OC43) i C (MERS-CoV)[82]. Powoduje to w porównaniu z SARS zwiększenie tropizmu tkankowego oraz zwiększenie transmisyjności i patogeniczności wirusa[39]. Niniejsze odkrycie oznacza, że sposób infekcji wirusa SARS-CoV-2 jest odmienny i groźniejszy niż w przypadku SARS[156]. Mechanizm mediacji procesu fuzji z komórkami gospodarza za pomocą furyny może implikować potencjalną strategię przeciwwirusową opartą na hamowaniu tego enzymu[82][154][153][157][155]. Wykazano, że wstępna aktywacja za pomocą furyny zwiększa wnikanie SARS-CoV-2 do różnych rodzajów linii komórkowych z ekspresją hACE2, w tym komórek nabłonka płuc i fibroblastów płucnych. Udowodniono również skumulowany wpływ TMPRSS2, katepsyn lizosomalnych i furyny na wnikanie komórkowe SARS-CoV-2. Wstępna aktywacja za pomocą furyny zmniejsza zależność SARS-CoV-2 od komórek docelowych, rozszerzając jego tropizm, w szczególności na komórki z relatywnie niską ekspresją TMPRSS2 i/lub lizosomalnych katepsyn[149].
| Właściwości wnikania komórkowego | SARS-CoV | SARS-CoV-2 | Implikacje dla SARS-CoV-2 |
|---|---|---|---|
| Częstość obserwacji domeny RBD w pozycji stojącej | Wysoka | Niska | Unikanie mechanizmów odporności (schowana domena RBD) |
| Powinowactwo domeny wiążącej receptor (RBD) do ludzkiego ACE2 | Słabe | Silne | Zwiększona zdolność wnikania (kompensacja ograniczonej dostępności domeny RBD) |
| Wstępna aktywacja za pomocą furyny | Nie | Tak | Zwiększenie tropizmu komórkowego (kompensacja ograniczonej dostępności domeny RBD) |
14 marca 2020 chińska grupa badaczy przedstawiła publikację, a której stwierdziła, że SARS-CoV-2 może wykorzystywać receptor białkowy CD147 jako dodatkową drogę inwazji komórek gospodarza. W badaniach in vitro naukowcy zaobserwowali, że przeciwciała monoklonalne skierowane przeciw CD147 (lek przeciwmalaryczny meplazumab) blokuje interakcję pomiędzy receptorem CD147 a glikoproteiną S wirusa SARS-CoV-2[158][159]. Lek meplazumab aktualnie poddawany jest ocenie klinicznej[160].
Postuluje się także, że białka GRP78 i ADAM17 również mogą pełnić funkcję receptorów dla SARS-CoV-2[161][162].
Replikacja wirusa

Reasumując, wykazano, że glikoproteina S1 wirusa SARS-COV-2 łączy się z receptorem ACE2 znajdującym się w wielu tkankach, głównie płucach, nerkach i w jelicie cienkim, oraz że proces wewnątrzkomórkowej fuzji wymaga aktywacji glikoproteiny S2 za pomocą cięcia enzymatycznego przez proteinę TMPRSS2, katepsynę lub furynę[163]. Dalszych badań wymaga jednak wciąż udział innych protein (np. CD147, GRP78, ADAM17) w procesie fuzji, co postulują naukowcy[156][164][165][166].
W powyżej opisany sposób wirion wnika do komórki poprzez endocytozę i uwalnia RNA do cytoplazmy[144][167].Po uwolnieniu wirusowego RNA do cytoplazmy komórki gospodarza, realizowana jest synteza poliprotein 1a/1ab (pp1a/pp1ab), produkowanych przez białka ORF1a i ORF1b[95][168][169]. Transkrypcja realizowana jest przez kompleks RCT, zorganizowany w pęcherzyki z podwójną błoną, i poprzez syntezę sekwencji subgenomowego RNA (sgRNA)[95]. Zakończenie transkrypcji występuje w sekwencjach regulatorowych, zlokalizowanych między otwartymi ramkami odczytu (ORF), które działają jako matryce do produkcji subgenomowych mRNA. Wszystkie białka strukturalne (N, S, M, E) i pomocnicze są translowane ze sgRNA koronawirusa. Szesnaście białek niestrukturalnych powstaje poprzez cięcie za pomocą proteaz 3CLpro, Mpro i jednej lub dwóch proteaz z rodziny papainy[95][163].
Nowo uformowane glikoproteiny płaszcza (E) są wstawiane do otoczki siateczki śródplazmatycznej lub aparatu Golgiego i przez połączenie genomowego RNA i białka nukleokapsydu (N) powstaje nukleokapsyd. Następnie cząstki wirusa łączą się w kompartment ERGIC (ang. endoplasmic reticulum-Golgi intermediate compartment). W końcu od wewnątrz komórki następuje fuzja pęcherzyków zawierających cząstki wirusa z błoną komórkową (egzocytoza) w celu uwolnienia nowego wirionu[167][168].
Słabo poznany jest sam proces egzocytozy wirusa.
Immunopatologia
Swoista odpowiedź immunologiczna odgrywa istotną rolę w infekcji SARS-CoV-2[170]. Wirus może z jednej strony unikać nadzoru immunologicznego w organizmie[171], z drugiej wywołać w ciężkich przypadkach burzę cytokin[172].
Osłabienie układu odpornościowego
SARS-CoV-2 wytwarza co najmniej trzy czynniki wirulencji, które promują rozprzestrzenianie się nowych wirionów z komórek gospodarza i hamują odpowiedź immunologiczną: Nsp1, Nsp3c oraz ORF7a[37].
Ze względu na podobieństwo do SARS, słuszne wydaje się założenie, że wirus SARS-CoV-2 może infekować limfocyty, szczególnie typu T, oraz inicjować lub promować śmierć komórek limfocytów, co zostało udowodnione w przypadku SARS. Hipoteza ta wyjaśnia, dlaczego u pacjentów zainfekowanych SARS-CoV-2 po fazie prozapalnej następuje etap supresji immunologicznej związany z trwałym i znaczącym zmniejszeniem liczby limfocytów obwodowych, głównie typu T CD4 i CD8, czyli stan znany jako limfopenia. Ponieważ limfocyty nie wykazują ekspresji ACE2, w celu udowodnienia tej hipotezy konieczne są jednak badania potencjalnego mechanizmu, dzięki któremu wirus mógłby atakować limfocyty[76].
Indukcja burzy cytokin
Spośród białek strukturalnych glikoproteina S (zwłaszcza domena A białka S1 oraz domena wiążąca receptor RBD) i N są najważniejszymi immunogenami[173][174].
Grupa naukowców z Melbourne pod kierownictwem Katherine Kedzierskiej dokonała studium przypadku pacjentki z łagodnym przebiegiem COVID-19 i przeanalizowała przebieg jej odpowiedzi immunologicznej, wskazując na podobieństwa do reakcji immunologicznej organizmu na wirusa grypy, będącej przedmiotem wcześniejszych badań tego zespołu. Badacze wykazali podwyższenie poziomu komórek wydzielających swoiste przeciwciała ASC, limfocytów pomocniczych grudkowych TFH, aktywowanych limfocytów CD4+ i CD8+ wraz z przeciwciałami IgM i IgG wiążącymi koronawirusa SARS-CoV-2. Schemat odpowiedzi immunologicznej może być przydatny przy prognozowaniu przebiegu choroby, opracowaniu szczepionki lub leków łagodzących przebieg choroby. Autorzy postulują jednak kontynuację badań na większej grupie pacjentów o różnych stopniach zaostrzenia choroby COVID-19[175].
Chińscy naukowcy wykazali, że infekcja wirusem SARS-CoV-2 wywołuje w organizmie aktywację limfocytów T CD4+, które następnie różnicują się w komórki limfocytów Th1 i wydzielają czynnik GM-CSF. Cytokiny te indukują inicjujące procesy zapalne monocyty CD14+CD16+ z wysoką ekspresją cytokin IL-6, co przyspiesza rozwój zapalenia płuc i odgrywa rolę w zwiększeniu ryzyka śmiertelności. Mając na uwadze, że u pacjentów z ciężkim przebiegiem COVID-19 zaobserwowano dużą liczbę nacieków zapalnych w płucach, naukowcy sugerują, że wspomniane wcześniej nieprawidłowe patogenne komórki Th1 i monocyty zapalne mogą dostać się w ogromnej liczbie do krążenia płucnego i odgrywać szkodliwą rolę immunologiczną, prowadząc do zaburzeń czynności płuc, a nawet śmierci klinicznej. Z tego powodu autorzy badania sugerują, że przeciwciała monoklonalne skierowane przeciw GM-CSF lub IL-6 mogą skutecznie blokować burzę zapalną i stanowić obiecującą terapię pacjentów z ostrym przebiegiem COVID-19[176].
Główną przyczyną śmierci u pacjentów w przebiegu COVID-19 jest zespół ostrej niewydolności oddechowej (ARDS). Spośród 41 pacjentów zakażonym wirusem SARS-CoV-2 we wczesnej fazie pandemii w Wuhan 6 zmarło właśnie na skutek ARDS. Jednym z głównych mechanizmów występujących w ARDS jest niekontrolowana systemowa odpowiedź zapalna w postaci burzy cytokin (IFN-α, IFN-γ, IL-1β, IL-6, IL-12, IL-18, IL-33, TNF-α, TGFβ itp.) oraz chemokin (CCL2, CCL3, CCL5, CXCL8, CXCL9, CXCL10), co prowadzi w konsekwencji do niewydolności oddechowej oraz niewydolności wielu organów i śmierci[138].
Przeciwciała SARS-CoV a SARS-CoV-2
Podczas testów na komórkach zwierzęcych (u myszy) badania wykazały, że przeciwciała monoklonalne mAb mogą rozpoznawać fragmenty glikoproteiny S wirusa SARS-CoV-2[177][178]. W środowisku laboratoryjnym zastosowano cztery mysie przeciwciała mAb: 2B2, 1A9, 4B12 i 1G10 na komórkach COS-7. Wyniki pokazały, że wspomniane cztery przeciwciała monoklonalne swoiste wobec SARS mogą reagować krzyżowo także z białkiem S (aa1048-1206) wirusa SARS-CoV-2[177]. Natomiast w osobnym eksperymencie zaobserwowano jedynie umiarkowaną reakcję krzyżową pomiędzy serum z przeciwciałami T62 specyficznymi wobec wirusa SARS, a wirusem SARS-CoV-2, co sugeruje, że przejście infekcji SARS nie chroni w pełni przed infekcją wirusem SARS-CoV-2, i vice versa[144].
Kolejny eksperyment ujawnił, że pomimo częstych reakcji krzyżowych pomiędzy przeciwciałami swoistymi wobec białka S lub domeny RBD wirusa SARS-CoV-2 oraz odpowiednich białek wirusa SARS (a także reakcji odwrotnych), neutralizacja krzyżowa wirusów występuje rzadko. Przykładem jest reaktywne krzyżowo przeciwciało CR3022 SARS, które pomimo silnego wiązania białek nie mogło zneutralizować SARS-CoV-2 in vitro. Implikuje to konieczność dalszych badań in vivo w celu określenia, czy nieneutralizujące odpowiedzi przeciwciał mogą powodować zależne od przeciwciał wzmocnienie replikacji wirusa, jak to zaobserwowano u innych koronawirusów. Identyfikacja epitopów ochronnych wobec szerszego spektrum białek S koronawirusów jest istotna do opracowania bardziej uniwersalnej szczepionki. Opisywane badanie sugeruje jednak, że tak szeroko ochronne epitopy reagujące krzyżowo nie występują w ludzkim organizmie[179].
Leczenie
Światowa Organizacja Zdrowia wprowadziła tymczasowy termin „ostra choroba układu oddechowego 2019-nCoV” na określenie choroby wywołanej przez wirusa[180]. Nazwa ta później została zmieniona na COVID-19 (choroba koronawirusowa 2019, ang. Coronavirus Disease 2019[181]). Obecnie nie istnieje leczenie przyczynowe, zalecane jest leczenie objawowe[27].
Poniżej opisano leczenie eksperymentalne, leki dopuszczone warunkowo oraz leki w trakcie badań.
W celu lepszego monitorowania i porównywania wyników badań najbardziej obiecujących eksperymentalnych leków przeciw wirusowi SARS-CoV-2 i chorobie COVID-19 w wielu krajach Światowa Organizacja Zdrowia wraz z partnerami podjęła w marcu 2020 roku współpracę na globalnym projektem „SOLIDARITY trial”, polegającym na koordynacji badań leków na całym świecie[182][183].
Szczepionka
Trwają prace nad szczepionkami przeciwko wirusowi SARS-CoV-2. Część krajów zatwierdziła już jednak pierwsze szczepionki do obrotu w tym Rosja[184], USA[185], UK[186], EU[187].
Ponieważ SARS-CoV-2 używa tego samego receptora, ACE2, jak SARS, możliwe było wykorzystanie wyników wcześniejszych badań nad SARS[95].
Rodzaje szczepionek
W trwających pracach nad szczepionkami próbuje się wytworzyć szczepionki typu[188][189]:
- Szczepionka inaktywowana, zawierająca inaktywowane lub martwe wirusy – ma na celu wywołanie szybkiej odpowiedzi immunologicznej organizmu ludzkiego na nową infekcję COVID-19. Podmioty pracujące nad tym typem szczepionki to między innymi: Johnson & Johnson razem z Sanofi, University of Hong Kong, Codagenix.
- Szczepionka podjednostkowa, zawierająca fragmenty wirusa, ma na celu uwrażliwienie układu odpornościowego na określone podjednostki wirusa. W przypadku wirusa SARS-CoV-2, badania skupiają się na glikoproteinie S, która łączy się z receptorem ACE2. Podmioty pracujące nad tym typem szczepionki to między innymi: University of Queensland, Novavax, Clover Biopharmaceuticals, Texas Children’s Hospital Center for Vaccine Development, ExpresS2io, iBion, Baylor College of Medicine, Sichuan Clover Biopharmaceuticals.
- Szczepionka oparta na kwasach nukleinowych RNA lub DNA, zawierająca zsyntetyzowany odcinek mRNA wirusa, który koduje białko na które reaguje układ immunologiczny[190]. Podmioty pracujące nad tym typem szczepionki to między innymi: Inovio Pharmaceuticals, Moderna, CureVac, Applied DNA Sciences.
Szczepionki wymagają badań dotyczących bezpieczeństwa i skuteczności ich stosowania[191]. Jednym z najważniejszych wyzwań, zwłaszcza przy opracowywaniu szczepionek opartych na pojedynczych białkach wirusa jest zapewnienie, aby szczepionka nie wywoływała zależnego od przeciwciał wzmocnienia replikacji wirusa (ADE, ang. antibody-dependent enhancement) oraz uzyskanie dłuższej niezawodności[192]. Po opracowaniu szczepionki proces badania bezpieczeństwa i skuteczności trwa około 18 miesięcy[193].
Zobacz też: Badania nad szczepionką SARS-CoV-2.
Przeciwwskazania do szczepienia
Według informacji dla pracowników brytyjskiej służby zdrowia, przeciwwskazaniem dla stosowania szczepionki Pfizer-BioNTech jest nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą[194]. Według wskazówek National Health Service szczepionki nie należy podawać osobom:
- u których wystąpiły reakcje alergiczne po pierwszym podaniu szczepionki Pfizer-BioNTech lub Moderny, lub mające historię ostrej reakcji anafilaktycznej
- z silną infekcją z towarzyszącą gorączką
- z właśnie trwającą chorobą COVID-19.
Przeciwwskazaniem nie są[195]:
- zaburzenia krwawienia
- przebycie COVID-19
- przedłużające się symptomy COVID-19 (warunkowo)
- upośledzony układ odpornościowy (zaleca się jak najszybsze przyjęcie szczepionki)
- niedawna lub zbliżająca się planowa operacja.
Brak jest wystarczających danych dotyczących szczepień kobiet w ciąży. W badaniach na zwierzętach nie stwierdzono jej szkodliwości, jednak przed podaniem należy rozważyć potencjalne ryzyko i korzyści[196].
Z kolei amerykańskie CDC nieco inaczej ustaliła przeciwwskazania[197]. Ogólne, nawet poważne reakcje alergiczne na leki czy pokarmy nie stanowią przeciwwskazania. W wypadku występowania w przeszłości takich reakcji alergicznych na leki konieczne jest jedynie zachowanie szczególnej ostrożności, ale nie jest to jednak przeciwwskazanie do podania szczepionki. Jednoznacznym przeciwwskazaniem według CDC jest tylko poważna reakcja alergiczna na składniki szczepionki Pfizer-BioNTech lub Moderny.
Komisja Europejska przyjęła podobne zalecenia i przeciwwskazania jak CDC[198]. W wypadkach podawanych przez NHS należy jedynie zachować ostrożność i obserwować pacjenta lub pacjentkę.
Leki przeciwwirusowe
Niektóre istniejące środki przeciwwirusowe, które są stosowane na przykład przeciwko MERS-CoV i HIV, mogą być skuteczne przy zakażeniu SARS-CoV-2[199][200][201][202]. Należą do nich inhibitory proteazy, takie jak indynawir, sakwinawir, lopinawir / rytonawir oraz interferon beta i remdesiwir[203][204]. Narodowa Komisja Zdrowia ChRL zaleca łączenie inhibitorów proteazy HIV lopinawiru i rytonawiru oraz rybawiriny z wziewnym interferonem alfa[205]. Badania z wykorzystaniem komórek Vero E6 wykazały, że w porównaniu z wirusem SARS nowy wirus SARS-CoV-2 wykazuje znacznie większą wrażliwość na terapię interferonami typu I, co skutkuje ograniczeniem jego replikacji[206]. Według doniesień mediów, pierwszy pacjent w Hiszpanii zarażony wirusem SARS-CoV-2 po terapii lopinawirem / rytonawirem powrócił do pełni zdrowia[207][208]. Należy zauważyć, że istnieją wyniki badań na 199 pacjentach w Chinach, które nie wykazały zadowalającej skuteczności lopinawiru/rytonawiru, jednak autorzy podkreślili krytyczny stan większości badanych pacjentów i fakt późnego wdrożenia leczenia[209]. Jak podała Polska Agencja Prasowa 13 marca 2020 roku, polscy pacjenci hospitalizowani w Wojewódzkim Szpitalu Specjalistycznym im. J. Gromkowskiego we Wrocławiu będą mieli możliwość leczenia lekami na HIV i malarię. Ze względu na eksperymentalny charakter leczenia, prof. Krzysztof Simon, ordynator szpitala, poinformował, że uzyskał zgodę komisji bioetycznej, a leki będą podawane za zgodą pacjenta[210].
Chińskie Centrum Kontroli i Prewencji Chorób testuje istniejące metody leczenia zapalenia płuc pod kątem skuteczności w leczeniu zapalenia płuc związanego z SARS-CoV-2[211]. Oprócz remdesiwiru aktualnie przeprowadzane są w Chinach testy fawipirawiru i chlorochiny (leku stosowanego przeciwko malarii) z udziałem ludzi[212][213]. Fawipirawir – lek przeciwko wirusowi grypy – jest testowany na 70 pacjentach w Shenzhen, a 16 lutego 2020 roku został dopuszczony w Chinach na 5 lat pod nową nazwą Favilavir jako eksperymentalny lek przeciw COVID-19 i natychmiast wdrożony do produkcji[214].
W badaniu 138 pacjentów w Chinach zastosowanie środka przeciwwirusowego oseltamiwir nie wykazało znaczących efektów leczniczych[215]. Również badanie in vitro nie wykazało działania przeciwwirusowego leków takich jak: velpatasvir, ledypaswir, litonavir, lopinawir, favilavir, sofosbuwir[216].
W badaniach in vitro obiecujące rezultaty związane były ze stosowaniem remdesiwiru, lopinawiru, emetyny oraz homoharringtoniny, które przyczyniały się do hamowania replikacji wirusa w hodowlach komórkowych Vero E6[217].
Chlorochina
Chlorochina została przetestowana na ponad 100 pacjentach w szpitalach w Pekinie oraz w prowincji Guangdong i znajduje się od 20 lutego 2020 roku wraz z umifenowirem (nazwa handlowa Arbidol) – dopuszczonym w Rosji i Chinach lekiem przeciwgrypowym – na liście leków zalecanych[218]. W eksperymencie klinicznym 27 lutego 2020 roku została potwierdzona skuteczność chlorochiny[219]. Pierwsze wyniki zostały opublikowane w czasopiśmie BioScienceTrends, gdzie uznano leczenie chlorochiną jako „bardziej skuteczne” niż leczenie z użyciem placebo[220]. Od 13 marca 2020 roku decyzją Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych lek z cholorochiną został dopuszczony do leczenia wspomagającego w leczeniu wirusa w Polsce[221][222]. Produkuje go polska firma Adamed pod nazwą Arechin.
Pomimo sygnałów o pozytywnym wpływie chlorochiny, wyniki pierwszych eksperymentów klinicznych 81 pacjentów z Brazylii sugerują, że wysokie dawki chlorochiny (to znaczy dawka całkowita 10-12g na cykl leczenia trwający 10 dni, według wcześniejszych zaleceń chińskiej Komisji Zdrowia w Prowincji Guangdong) mogą skutkować wydłużeniem QTc u pacjentów, a nawet zwiększonymi wskaźnikami śmiertelności[223].
Remdesiwir
Remdesiwir wydaje się jednym z najbardziej obiecujących leków eksperymentalnych w leczeniu koronawirusa SARS-CoV-2. Potwierdzono skuteczność remdesiwiru in vitro[224][225]
Naukowcy z University of Alberta w Kanadzie oraz z USA na podstawie badań in vitro odkryli mechanizm hamowania przez remdesiwir syntezy RNA u koronawirusów, z uwzględnieniem SARS-CoV-2. Lek ten należy do klasy analogów nukleotydów i wykazywał w poprzednich badaniach in vitro oraz in vivo szerokie spektrum działania wobec wirusów takich jak Ebola, wirus Nipah, SARS, MERS i innych koronawirusów.
Replikacja SARS-CoV-2 jest oparta na wirusowej polimerazie RNA zależnej od RNA (białka Nsp7, Nsp8, Nsp12). Badacze wykazali, że RNA-zależna polimeraza RNA włącza remdesiwir w formie farmakologicznie czynnego trifosforanu (RDV-TP) do RNA. Włączenie RDV-TP w pozycji i powoduje terminację syntezy RNA w pozycji i+3. RDV-TP wykazuje wysoką selektywność w porównaniu z odpowiednikiem Adenozyno-5′-trifosforanem (ATP) i lekami takimi jak sofosbuwir, fawipirawir, rybawiryna.
Przedstawiony mechanizm prowadzi do konkluzji, że remdesiwir jest środkiem o bezpośrednim działaniu przeciwwirusowym (DAA, ang. Direct-Acting Antiviral)[226].
Rysunek obrazuje biochemiczny mechanizm hamowania syntezy RNA-zależnej polimerazy RNA przez RDV-TP u koronawirusów SARS-CoV, MERS-CoV i SARS-CoV-2, który składa się z kilku etapów[226]:
- Nić primera jest przedstawiona za pomocą kółek (nukleotydów) z zielonym wypełnieniem, kółka z białym wypełnieniem reprezentują nić matrycy, a niebieski owal reprezentuje obszar aktywności RNA-zależnej polimerazy RNA. Jest to schematyczne przedstawienie losowego kompleksu elongacyjnego.
- Zjawisko konkurencji pomiędzy RDV-TP i jego odpowiednikiem ATP o miejsce wiązania w matrycy naprzeciwko urydyny (U). Wbudowany analog nukleotydu jest oznaczony czerwonym kółkiem.
- Terminacja (zakończenie) syntezy RNA następuje z opóźnieniem po przyłączeniu trzech kolejnych nukleotydów.
- Opóźnioną terminację łańcucha można wyeliminować przez wysoki stosunek trifosforanów nukleozydów do RDV-TP.
W randomizowanym, wieloośrodkowym, kontrolowanym placebo badaniu prowadzonym metodą podwójnie ślepej próby na 237 pacjentach w dziesięciu szpitalach w chińskiej prowincji Hubei (z czego 158 było leczonych remdesiwirem), leczenie remdesiwirem nie wiązało się ze znaczącymi statystycznie korzyściami klinicznymi[227].
Remdesiwir pozostaje wciąż środkiem eksperymentalnym, ponieważ wymaga dalszych badań na modelach zwierzęcych i eksperymentów klinicznych na ludziach. Obecnie w Stanach Zjednoczonych, Chinach i Włoszech trwa 3 faza badań klinicznych, sprawdzających skuteczność tego leku – publikacja wyników spodziewana jest do końca kwietnia 2020 roku[228][229][230][231][232]. Lek nie jest dopuszczony do obrotu w żadnym kraju.
1 maja 2020 amerykańska FDA, bazując na wstępnych wynikach badań klinicznych z USA[233][234], dopuściła remdesiwir do interwencyjnego stosowania w ciężkich przypadkach zakażenia wirusem SARS-CoV-2[235].
Tocilizumab
W styczniu 2021 brytyjski National Institute for Health Research zalecił użycie tocilizumabu (8 mg/kg) dla krytycznie chorych pacjentów z COVID-19 w ciągu pierwszych 24 godzin od rozpoczęcia intensywnej terapii podtrzymującej funkcjonowanie organów. Zalecenie sformułowano na podstawie wstępnych wyników badań kierowanych przez Imperial College London i obejmujących 353 chorych, wśród których – w porównaniu do kontrolnej grupy 402 pacjentów – śmiertelność była niższa o 24%, a intensywna terapia krótsza średnio o 10 dni[236][237].
Zapobieganie burzy cytokin
Burza cytokin, zagrażająca życiu reakcja immunologiczna, może być powikłaniem choroby COVID-19, wywoływanej przez SARS-CoV-2.
Istnieją dowody, że hydroksycholorochina posiada właściwości hamujące burzę cytokin[238]. Niektórzy naukowcy proponują jako potencjalną terapię łączenie hydroksychlorochiny z nitazoksanidem w celu zwiększenia skuteczności[239].
Narodowa Komisja Zdrowia ChRL na podstawie badań na małych grupach osób włączyła tocilizumab do wytycznych w zakresie leczenia pacjentów[240][241]. Lek ten jest przeciwciałem monoklonalnym przeciw IL-6. Aktualnie znajduje się w 2 fazie badań klinicznych we Włoszech po wykazaniu pozytywnych efektów u osób z ciężkim przebiegiem choroby[242][243][244]. W Stanach Zjednoczonych lek funkcjonuje pod nazwą Actemra i został dopuszczony przez FDA do leczenia innych chorób[245][246].
Terapia przeciwciałami
Obiecującą potencjalną terapią ciężkich przypadków zakażenia może być leczenie specjalnie spreparowanym osoczem krwi, zawierającym swoiste przeciwciała zwalczające wirusa SARS-CoV-2 pozyskane od ozdrowieńców po COVID-19 (infekcji wywołanej tym gatunkiem koronawirusa)[247][248][249]. Skuteczność tego rodzaju immunizacji została ogłoszona przez chiński koncern National Biotec Group[250][251][252].
Inne
Inhibitory proteazy Mpro
Podstawą do poszukiwania leku przeciw wirusowi SARS-CoV-2 są badania grupy naukowców, w skład której wchodzi Marcin Drąg z Politechniki Wrocławskiej. Badacze, opierając się na doświadczeniach z wirusem SARS, zidentyfikowali enzym Mpro (lub 3CLpro, czyli główną proteazę), który jest kluczowy w procesie cięcia białek wirusa i jego replikacji. Autorzy sugerują, że zahamowanie tego enzymu jest kluczową formą terapii przeciwwirusowej[253]. Podobne stanowisko zajął zespół naukowców z Niemiec, którzy w późniejszej publikacji potwierdzają znaczenie proteazy Mpro w leczeniu[254]. Obydwie grupy badaczy podkreślają, że ponieważ proteaza ta nie występuje w organizmie człowieka, potencjalny lek będący jej inhibitorem cechowałby się brakiem skutków ubocznych i małą toksycznością dla człowieka[253][254]. Jak poinformowały media, badacze z Politechniki Śląskiej, University of Alberta z Kanady i Politechniki Turyńskiej utworzyły międzynarodowy zespół Tunnelling Group, badający enzym Mpro i potencjalne leki[255][256].
Zespół naukowców z Chińskiej Akademii Nauk wykorzystując metody teoretyczne 3D, bazujące na integracji technik modelowania homologicznego struktury Mpro, dokowania molekularnego cząsteczek wybranych leków i obliczeniach energii wiązania wskazał nelfinavir jako potencjalny inhibitor głównej proteazy (Mpro) wirusa SARS-CoV-2[200].
Grupa naukowców z Brazylii przedstawiła wyniki badań, w których wskazała, że lek atazanawir może być skutecznym środkiem równocześnie hamującym proteazę Mpro, jak i zapobiegającym burzy cytokin[257].
Inhibitory wiązania z ACE2
Prof. Krzysztof Pyrć i grupa naukowców z Uniwersytetu Jagiellońskiego opracowali inhibitory polimerowe HTCC, które bazują na modyfikowanym kationowo chitozanie. W oparciu o badania in vitro i ex vivo wirusa SARS-CoV-2 oraz innych koronawirusów badacze stwierdzili wysoką skuteczność hamowania wiązania glikoproteiny S z receptorem komórkowym ACE2 (ang. angiotensin-converting enzyme 2) za pomocą HTCC. Co więcej, naukowcy sugerują, że inhibitory HTCC mogą być dostosowane do hamowania dowolnego z wirusów z rodziny Coronaviridae (historyczne badania wykazały efektywność względem HCoV-NL63, HCoV-OC43, HCoV-229E, HCoV-HKU1, MERS oraz SARS-CoV-2), a w badaniach nie zaobserwowano toksyczności. Ponieważ nowa substancja nie jest dopuszczona do stosowania u ludzi, konieczne są jednak dalsze eksperymenty[258][259].
Inhibitory TMPRSS2
Grupa niemieckich naukowców pod przewodnictwem Christiana Drostena przedstawiła w publikacji[150], że enzym TMPRSS2 (seryna 2), wymagany do rozmnażania wirusa, może być skutecznie hamowany za pomocą leku stosowanego w leczeniu przewlekłego zapalenia trzustki. Lek Camostat jest dopuszczony w Japonii i może zostać poddany bezpośrednio eksperymentom klinicznym.
Innym inhibitorem TMPRSS2 jest dostępna powszechnie bromheksyna[260][239], która jest poddawana klinicznej ocenie skuteczności leczenia u pacjentów z chorobą COVID-19[261].
Proteina Ly6e
Interesujące pod kątem potencjalnego leczenia SARS-CoV-2 są odkrycia naukowców pod przewodnictwem Johna Schogginsa z University of Texas Southwestern, które następnie zostały podjęte i kontynuowane przez grupę naukowców pod przewodnictwem Stephanie Pfaender ze Szwajcarii[262]. Grupa Johna Schogginsa odkryła, że ludzkie białko Ly6e zwiększa wirulencję (wnikanie i mnożenie) niektórych wirusów osłonkowych RNA, takich jak HIV-1, wirusa Gorączki Zachodniego Nilu, wirusa dengi czy wirusa Zika. Paradoksalnie, podczas testów na myszach naukowcy zauważyli, że po usunięciu genu Ly6e zwierzęta stały się niezwykle podatne na infekcje różnego rodzaju koronawirusami, co sugerowało odwrotny wpływ białka Ly6e na ten rodzaj wirusów[263]. Potwierdziły to badania grupy Stephanie Phaender, która wykazała in vitro oraz in vivo na myszach, że Ly6e silnie powstrzymuje infekcje wywołane różnymi typami koronawirusów, takimi jak HCoV-229E, MERS-CoV, SARS-CoV czy SARS-CoV-2, jednocześnie wywołując odwrotny efekt (tj. sprzyjając infekcji) podczas badania wirusów grypy typu A, flawiwirusów i HIV-1. W szczególności Ly6e powstrzymywała mediowaną przez glikoproteinę S fuzję osłonki wirusa z komórkami gospodarza. Wykazano również, że Ly6e bezpośrednio chroni limfocyty B i komórki dendrytyczne przed infekcją CoV u myszy. Podejście terapeutyczne naśladujące mechanizm działania Ly6e może zapewnić pierwszą linię obrony przed infekcjami koronawirusowymi[264].
Procedura triażu i leczenia pacjentów w Wuhanie
W centrum medycznej segregacji w Wuhanie schemat diagnostyki i leczenia pacjentów z podejrzeniem zakażenia zakłada stosowanie przeciwwirusowego umifenowiru i antybiotykoterapię linezolidem, nemonoksacyną lub fluorochinolonami. Leczenie antybiotykami jest uzasadnione oczekiwaniem wtórnego zakażenia bakteryjnego tkanki płucnej uszkodzonej przez infekcję wirusową. Autorzy podkreślają znaczenie rozpoczęcia terapii przed potwierdzeniem diagnozy za pomocą testu RT-PCR, na podstawie wyników badań przedmiotowych, laboratoryjnych i diagnostycznych. Pacjenci bez obniżonej liczby limfocytów we krwi, bez wirusowego zapalenia płuc, bez duszności i bez zmniejszenia saturacji krwi tlenem poniżej 93% powinni zostać wypisani do opieki domowej bez badania RT-PCR. Dla tych pacjentów przeznaczona jest doustna azytromycyna lub amoksycylina. Pacjenci z zapaleniem płuc o innej niż CoV-2 patogenezie powinni być leczeni systematycznie i, jeśli to możliwe, w warunkach ambulatoryjnych. Kobiety w ciąży i osoby powyżej 65. roku życia powinny być traktowane podczas leczenia hospitalizacyjnego jako grupy szczególnego ryzyka. Autorzy badania uzasadniają swoje podejście przeciążeniem systemu opieki zdrowotnej w Wuhanie. Leczenie jak największej liczby pacjentów w domach wiąże się z ryzykiem, ale jest konieczne w celu równoczesnego leczenia wielu przypadków krytycznych[265].
Profilaktyka
Zalecenia profilaktyczne:
- Często myć ręce, ciepłą wodą i mydłem, przez co najmniej 30 sekund, szczególnie przed jedzeniem, po wydmuchaniu nosa, kaszlu lub kichaniu, po kontakcie z osobami chorującymi lub ich otoczeniem. Gdy mydło i woda nie są łatwo dostępne, należy dezynfekować ręce z co najmniej 60% objętościowym alkoholem.
- Unikać dotykania nosa, oczu i ust nieumytymi rękami.
- Unikać bliskiego kontaktu z wykazującymi objawy chorób układu oddechowego.
- Wystarczająco długo gotować mięso, ryby i owoce morza.
- Zasłaniać nos i usta chusteczką higieniczną podczas kichania i kasłania.
- W placówkach opieki zdrowotnej wzmocnić standardowe praktyki zapobiegania i kontroli zakażeń w szpitalach, zwłaszcza na oddziałach ratunkowych[266][267][268][269]
- Nosić sprzęt indywidualnej ochrony układu oddechowego (na przykład półmaski filtrujące) chroniące usta i nos[270].
Jednym ze środków prewencyjnych jest kwarantanna osób zakażonych podejrzanych o zakażenie wirusem, oraz mających kontakt z zakażonymi oraz przebywających w miejscach gdzie występuje epidemia[271].

Pojawienie się wirusa zwróciło uwagę na wirusy odzwierzęce[272]. Przeniesieniu się wirusa sprzyjają takie obecne w Chinach czynniki, jak wzrost liczebności populacji, wylesianie, urbanizacja, zmiana klimatu, aspekty związane z produkcją żywności i trzymaniem zwierząt, a w końcu mutacja. Po poprzednich epidemiach zoonoz wirusowych rząd Chin podjął działania przeciwdziałające powtórzeniu się sytuacji[273]. Li i współpracownicy zwracają uwagę na ograniczony charakter dotychczas podjętych działań mających zapobiec przenoszeniu się chorób wirusowych z innych gatunków zwierząt na człowieka[272].
Epidemiologia
Ze względu na dużą epidemiologię nowego wirusa 11 marca 2020 roku Światowa Organizacja Zdrowia sklasyfikowała rozprzestrzenianie się wirusa SARS-CoV-2 jako pandemię[274].
Zobacz też
- choroba COVID-19
- pandemia COVID-19 w Polsce
- pandemia COVID-19 na świecie
- koronawirusy
- SARS-CoV-1 – koronawirus odpowiedzialny za pandemię z lat 2002–2003
- SHC014-CoV – koronawirus podobny do SARS