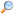Higany
A higany a periódusos rendszer egyik kémiai eleme. Vegyjele Hg, rendszáma 80. Angolszász elnevezése (INN: mercury) a fém cseppfolyós halmazállapotából adódó mozgékonyságára utalva a római mitológia isteneinek hírvivőjéről kapta a nevét, míg német neve (Quecksilber) annyit tesz: „fürge ezüst”. Az elem vegyjele a hydrargyrum (latin, folyékony ezüst (Ag)) szóból származik. Elemi állapotban ezüstös, fémszínű, cseppfolyós, vezeti a hőt és az elektromos áramot, könnyen párolog, ezért zárva tárolandó nehézfém.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Általános | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Név, vegyjel, rendszám | higany, Hg, 80 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Latin megnevezés | hydrargyrum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemi sorozat | átmenetifémek | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Csoport, periódus, mező | 12, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Megjelenés | ezüstfehér | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtömeg | 200,592(3) g/mol[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronszerkezet | [Xe] 4f14 5d10 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronok héjanként | 2, 8, 18, 32, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Halmazállapot | folyékony | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sűrűség (szobahőm.) | (folyadék) 13,534 g/cm³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hármaspont | 234,3156 K, 0,000165 Pa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olvadáspont | 234,3210 K (−38,8290 °C, −37,8922 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forráspont | 629,88 K (356,73 °C, 674,11 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olvadáshő | 2,29 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Párolgáshő | 59,11 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moláris hőkapacitás | (25 °C) 27,983 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomi tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristályszerkezet | romboéder | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidációs szám | 2, 1 (gyengén bázikus oxid) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitás | 2,00 (Pauling-skála) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizációs energia | 1.: 1007,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.: 1810 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.: 3300 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsugár | 150 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsugár (számított) | 171 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalens sugár | 149 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals-sugár | 155 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egyebek | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mágnesség | diamágneses | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektromos ellenállás | (25 °C) 961 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hőmérséklet-vezetési tényező | (300 K) 8,30 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hőtágulási együttható | (25 °C) 60,4 µm/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hangsebesség | (folyadék, 20 °C) 1451,4 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-szám | 7439-97-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-kód | D08AK05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fontosabb izotópok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hivatkozások | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Története
Az alkimisták régen fontos anyagnak tartották az arany (Au) előállításához vezető úton, természetesen ennek nincs kémiai értelemben valóságalapja. Az álom azonban mégis valóra vált, amikor az 1990-es években a higanyatomok átmeneti protonbefogásával, majd az azt követő alfa-bomlás során sikerült egy, a természetben nem előforduló aranyizotópot előállítani. E módszer gyakorlati alkalmazása arany előállítására a rendkívüli energiaigény miatt gazdaságtalan.
Magyar nevének eredete
A higany magyar neve egészen a 19. századig kéneső volt.
Bejegyzés az 1862-es Czuczor-Fogarasi: A Magyar Nyelv Szótárából:
„KÉNÌSŐ, (2), (kén-ìs-ő vagy ken-es-ő) fn. tt. kénìső-t. Gyöke vagy az ásványt jelentő kén, melyből lett kénìs, és az elavult ige kénìsik, azaz kénes állapotban van, s ebből igenév és főnév kéneső; vagy mint némelyek vélekednek, am. keneső, amivel kenni szoktak, különösen a melyet üvegre kennek, és ez által tükröt készítenek. 1) Szoros ért. vörös szinű ásvány, mely higanyból és kénből van vegyítve. (Cynnabaris). Innen 2) így nevezik magát a tiszta higanyt, azaz természeténél fogva a mi légmérsékletünkben híg, ezüst gyanánt fehérlő, és fényes félérczet is, mely az arany után legsulyosabb, kis nyomás által apró részecskékre oszolva szétfut, nagy tűzben forr s gőzzé válik, de meghűlés után ismét elébbi alakjában megjelenik. (Mercurius). Eleven kéneső, minthogy igen mozgékony.”[3]
A higany, vagyis „híg anyag” szót Schuster János alkotta meg. Egy másik mesterségesen alkotott szó az elem megjelölésére a szerdany volt (a szerda szóból, amely Merkúr isten napja), de ez nem terjedt el.[4]
Jellemzői
Sűrűsége az ezüstnél (Ag) és az ólomnál (Pb) is nagyobb, 13,6 g/cm³. Rokonságot mutat a nemesfémekkel. Levegőn állandó, a levegő oxigénjével nem reagál; sem híg, sem tömény sósavban nem oldódik. Reakcióképessége alacsony, ezért csak híg salétromsav (HNO3), és forró, tömény kénsav (H2SO4) támadja meg. A higany más fémekkel alkotott hideg ötvözete az amalgám. A folyékony higany nagy mennyiségű ammónium-hidroxidot (NH4OH) is képes elnyelni, a keletkező ammónium-amalgám tejszínhabszerű, felpuffadt, habos szürke massza. Hőtágulási együtthatója közel lineáris, így arányos térfogatváltozással reagál a hőmérsékleti különbségekre. Ez, valamint széles folyadéktartománya (közel 400 °C) alkalmassá teszi hőmérőkben való használatra.
Előfordulása, előállítása
A higany előfordulása és forrása a cinnabarit (higany-szulfid:HgS), amely a korábbi vulkáni tevékenység vonulatai mentén található. Leggyakoribb és legkiterjedtebb lelőhelyek a spanyolországi Almadén környékén vannak, ahol az ércek higanytartalma a 6–7%-ot is elérheti, és ezek kitermelése már az ókori Római Birodalom idején elkezdődött. Az egyéb lelőhelyek – amelyek többnyire kevesebb mint 1% higanyt tartalmaznak – a korábbi Szovjetunió, Algéria, Mexikó, Szlovénia és Olaszország területén találhatók.
Előállítása pörköléssel történik. A legprimitívebb eljárás szerint a cinnabaritot egyszerűen rőzselángon hevítették. Ez tüzelőanyagként és kondenzátorként egyaránt szolgált, miközben a fémes higany a hamuban gyűlt össze. A modern eljárásoknál az ércet először őrlik, majd flotálással dúsítják, amit a folyamatos levegőáramban való pörkölés (600 °C) és a keletkezett gőzök kondenzáltatása követ:
Lehetséges – különösen a higanyban gazdag ércek esetén – vasforgáccsal (Fe) vagy égetett mésszel (CaO) is pörkölni:
A forró, folyékony, nyers fémen levegőt fúvatva át a szennyező fémek (Fe, Cu, Zn és Pb) nyomai oxidálódnak, és könnyen elválasztható salakot képeznek. Ezt csökkentett nyomáson desztillálva tovább tisztítják. Évente mintegy 4000 tonna higanyt használnak fel, de ennek csak kb. a fele az újonnan bányászott és előállított mennyiség, a többi másodlagos termelésből és tartalékkészletek kiárusításából származik.
Felhasználása
Használatos hőmérőkben, lázmérőkben, barométerekben, vérnyomásmérőkben, higanygőzlámpákban, kapcsolókban. A higany más fémekkel alkotott hideg ötvözete az amalgám; ezüst-, cink- stb. tartalmú fajtáját még ma is alkalmazzák rágófogak tömésére a fogászatban, mivel igen ellenálló, tartós anyag. A kimutatható higany kioldódás miatt e felhasználása ma már fogászati, toxikológiai viták tárgya. Ennek ellenére az USA fogász egyesülete nem ismeri el a káros hatásokat, s továbbra is biztonságos módszerként tünteti fel.[5] A fejlettebb országokban használatát már felváltották más, korszerűbb anyagok. Tetvesség, fülbajok és bőrbetegségek ellen volt sokáig használatos az ún. szürke huszárzsír (ung. hydrargyri).Legfontosabb ipari alkalmazási területe azonban a higanykatódos NaCl-elektrolízisben van, de itt is kezd háttérbe szorulni a modernebb membráneljárások elterjedése következtében.Az antibiotikum felfedezése előtt többek között a szifilisz gyógyítására is alkalmazták.
- Higanyhőmérő
- Higanyos barométer
- Amalgámtömés
- Higanykapcsoló
Vegyületei
- lásd még: A higany vegyületei
| C2H6Hg | dimetil-higany |
| HgC2N2 | higany(II)-cianid |
| HgC2N2O2 | higany-fulminát |
| HgI2 | higany-jodid |
| Hg2Cl2 | higany(I)-klorid, kalomel |
| HgCl2 | higany(II)-klorid, szublimát |
| Hg2O | higany(I)-oxid |
| HgO | higany-oxid |
| HgSO4 | higany(II)-szulfát |
| HgS | higany-szulfid |
| C20H8Br2HgNa2O6 | merbromin |
A higanyvegyületek toxikológiája
Jelen tudásunk szerint az élő szervezetek számára mindössze 24, a természetben megtalálható úgynevezett biogén elem mondható nélkülözhetetlennek. A higany nem tartozik ezek közé, de mégis sok szervezetben megtalálható rendkívül kis mennyiségben, amely a talaj, a víz, a levegő állandó higanytartalmából származik. Általánosságban elmondható, hogy az így bekerült kis mennyiségű higany nem okoz zavart a bioszférában vagy az ember életében.[6]
A higany az élő szervezetekben egy kritikus koncentrációt elérve viszont már terhelő, kifejezetten toxikus elemmé vagy vegyületté válik, ezzel veszélyt jelentve az emberre és a környezetére.[7] A higanyvegyületeknek a higany oxidációs állapotától függő karakterisztikus toxikokinetikájuk és egészségkárosító hatásuk van. Méregtani szempontból tehát nem közömbös, hogy a higany milyen kémiai formában jut a szervezetbe. A mérgezés mechanizmusa és az érintett célszervek károsodása szempontjából a higany három kémiai formájának van jelentősége:[8]
- elemi higany (folyékony vagy gőz állapotban)
- szervetlen higanysók (merkurisók)
- szerves higanyvegyületek
Általánosságban elmondható, hogy a higanysók elsődleges támadáspontja a vese. Ezzel szemben az elemi higany és a szerves higanyvegyületek elsősorban a központi idegrendszert károsítják.[9]
Amennyiben törött hőmérőből, vagy más módon kerül az ember környezetébe higany, az folyamatosan párologni fog, és súlyosan mérgező lesz, amíg teljesen el nem párolog. A káros hatások elkerülhetőek, ha a kifolyt higany összegyűjtésére és a szennyezett környék kénporral való beszórására sor kerül. A higany ilyenkor – a tévhittel ellentétben – nem alakul ártalmatlan higany-szulfiddá, hanem csupán felületi feszültsége csökken kis mértékben, ami megkönnyíti összegyűjtését, viszont a mérgező higanygőzök párolgását ez nem befolyásolja.
Jegyzetek
Források
- N.N. Greenwood, A. Earnshaw: Az elemek kémiája, Nemzeti Tankönyvkiadó, Budapest, 1999.
További információk
- a magyar Wikipédia higanyt tartalmazó vegyületeinek listája külső keresővel