Карбонові кислоти
Карбо́нові кисло́ти — органічні сполуки, що містять одну або декілька карбоксильних груп COOH. За кількістю цих груп розрізняють одноосновні (бензойна, оцтова кислота), двоосновні (щавлева, малонова, фталева, азелаїнова кислота) та багатоосновні (лимонна кислота). Залежно від числа карбоксильних груп в молекулі, карбонові кислоти підрозділяються на одноосновні (суфікс -ова), двоосновні (суфікс -діова), триосновні (суфікс -тріова), тощо.
| Карбонові кислоти | |
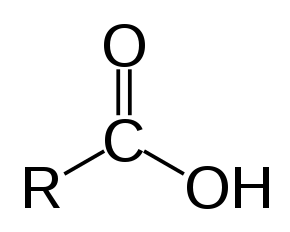 | |
| Загальна формула | RC(=O)OH |
|---|---|
| Канонічна формула SMILES | OC([*])=O[1] |
| Нотація SMARTS | [CX3](=O)[OX1H0-,OX2H1] |
| CXSMILES | [*]C(=O)O |$_R$| |
| | |

Синонім — карбоксильні кислоти.
Фізичні властивості
За стандартних умов, аліфатичні насичені одноосновні карбонові кислоти, що мають до 9 атомів вуглецю — рідини, вищі карбонові кислоти — тверді речовини. Ароматичні та двоосновні карбонові кислоти є кристалічними речовинами. Карбонові кислоти, що мають до 4 атомів вуглецю, добре розчиняються в воді, вищі кислоти — погано розчинні.[2][3][4]
Хімічні властивості
Карбонові кислоти — органічні сполуки 



Кислотність
У молекулах карбонових кислот, як і в молекулах спиртів, містяться гідроксильні групи, унаслідок чого кислоти виявляють деяку схожість із спиртами. Але в кислотах гідроксильна група перебуває під впливом групи атомів карбонілу, в той час як в спиртах на неї впливає вуглеводневий радикал. Вплив карбонільної групи на гідроксил проявляється, зокрема, в тому, що атом водню гідроксильної групи в кислотах значно більш «кислотний», ніж у спиртах: легше заміщується металом і може відщеплюватися у вигляді катіона, тому карбонові кислоти йонізуються у воді та інших полярних розчинниках. При взаємодії з лужними металами, основними оксидами та основами утворюють солі:


Переважно є слабкими кислотами (рКа 4–5), тому їх солі зазнають гідролізу. Кислотність підсиюється зі збільшенням електроноакцепторности замісника R. Ароматичні карбонові кислоти сильніші за насичені аліфатичні.
Похідні карбонових кислот
Внаслідок дегідратації утворюють ангідриди. Дегідрувальним агентом може бути, наприклад, оксид фосфору(V):

Інколи молекула води може відщеплюватися від однієї молекули кислоти, а не від двох. Тоді утворюються кетени:

Гідроксильна група здатна замінюватись на алкоксильну, утворюючи естери. Реакція потребує кислотного каталізатора:

При реакції з аміаком або амінами утворюються аміди:

При реакції з такими сполуками, як, наприклад тіонілхлорид або хлорид фосфору (V) утворюються галогенангідриди:

Відновлення
Можуть бути відновлені до спиртів. Як відновник застосовується алюмогідрид літію. У промисловості застосовують каталітичне гідрогенування.
Декарбоксилювання
Декарбоксилюються при нагріванні в присутності лугів, при цьому карбоксильна група відщеплюється у вигляді вуглекислого газу. Процес полегшується електроноакцепторними групами в α-положенні. Особливо нестабільними є β-оксокилоти, які декарбоксилюються навіть за кімнатної температури у відсутності лугів.

Інший варіант декарбоксилювання - кетонне декарбоксилювання. При цьому дві молекули карбонової кислоти з'єднуються, утворюючи кетон:

Назви карбонових кислот
| Систематична назва | Структурна формула | Традиційна назва |
|---|---|---|
| Насичені одноосновні | ||
| Метанова кислота | НСООН | Мурашина кислота |
| Етанова кислота | СН3СООН | Оцтова кислота |
| Пропанова кислота | C2H5COOH | Пропіонова кислота |
| Бутанова кислота | С3Н7СООН | Масляна кислота |
| Пентанова кислота | С4Н9СООН | Валеріанова кислота |
| Гексанова кислота | С5Н11СООН | Капронова кислота |
| Гексадеканова кислота | С15Н31СООН | Пальмітинова кислота |
| Октадеканова кислота | С17Н35СООН | Стеаринова кислота |
| Ненасичені одноосновні | ||
| Проп-2-енова кислота | СН2=СНСООН | Акрилова кислота |
| Октадец-9-енова кислота | С17Н33СOOН | Олеїнова кислота |
| Насичені двоосновні | ||
| Етандіова кислота | HOOCCOOH | Щавелева кислота |
| Пропандіова кислота | HOOCCH2COOH | Малонова кислота |
| Бутандіова кислота | НООССН2СН2СООН | Бурштинова кислота |
Див. також
Джерела
- В. І. Саранчук, М. О. Ільяшов, В. В. Ошовський, В. С. Білецький. Хімія і фізика горючих копалин. — Донецьк: Східний видавничий дім, 2008. — с. 600. ISBN 978-966-317-024-4
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк: Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
Література
- Функціональні похідні карбонових та вугільної кислот: Навч. посіб. для студ. хім. спец. ун-тів / М. І. Ганущак, В. В. Карп'як; Львів. нац. ун-т ім. Івана Франка. — Л., 2002. — 292 c. — Бібліогр.: 25 назв.
Посилання
| Вікісховище має мультимедійні дані за темою: Карбонові кислоти |
- Кислоти карбонові // Фармацевтична енциклопедія / голова ред. ради та автор передмови В. П. Черних. — 2-ге вид., переробл. і доповн. — К. : «МОРІОН», 2010. — 1632 с. — ISBN 978-966-2066-34-0.
- Назви карбонових кислот